题目内容
【题目】相同温度下,容积相同的甲、乙两个恒容密闭容器中均发生如下反应:2SO2(g)+O2(g) ![]() 2SO3(g) △H=-197 kJ/mol ,实验测得有关数据如下:
2SO3(g) △H=-197 kJ/mol ,实验测得有关数据如下:
容器编号 | 起始时各物质的物质的量 / mol | 达到平衡时体系能量的变化/kJ | ||
SO2 | O2 | SO3 | ||
甲 | 2 | 1 | 0 | 放出热量:Q1 |
乙 | 1.8 | 0.9 | 0.2 | 放出热量:Q2 |
下列判断中正确的是
A.两容器中反应的平衡常数不相等
B.达到平衡时SO2的体积分数:甲<乙
C.197>Q1>Q2
D.生成1molSO3(l)时放出的热量等于98.5kJ
【答案】C
【解析】
A.甲、乙两个容器内温度相等,则平衡常数相等,A错误;
B.将乙中转化为到左边,SO2、O2的起始物质的量相当于2mol、1mol,甲、乙温度、体积相等,故二者为完全等效平衡,平衡时SO2的体积分数相等,B错误;
C.甲、乙为完全等效平衡,平衡时二氧化硫的物质的量相等,故甲中参加反应的二氧化硫更多,则放出热量:Q1>Q2,由于该反应为可逆反应,反应物不能完全反应,故197>Q1,则放出热量:197>Q1>Q2,C正确;
D.同种物质,液态的能量低于气态,生成液态三氧化硫放出的热量更多,即生成1molSO3(l)时放出的热量大于98.5kJ,D错误;
故合理选项是C。

 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案【题目】用如图所示的装置进行中和热的测定实验,分别取50 mL 0.55 mol/L的NaOH溶液、50 mL 0.25 mol/L的硫酸进行实验,回答下列问题:
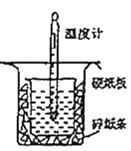
(1)从图中实验装置看,其中尚缺少的用品是_______,除此之外,装置中的一个明显错误是_______。
(2)近似认为0.55 mol/L的NaOH溶液和0.25 mol/L的硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃),通过以下数据计算中和热△H=_________。(结果保留小数点后一位)。
温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | ||
H2SO4 | NaOH | 平均值 | ||
1 | 26.2 | 26.0 | 26.1 | 29.5 |
2 | 27.0 | 27.4 | 27.2 | 32.3 |
3 | 25.9 | 25.9 | 25.9 | 29.2 |
4 | 26.4 | 26.2 | 26.3 | 29.8 |
(3)若改用50 mL0.25 mol/L的H2SO4和50 mL0.55 mol/L的NH2·H2O溶液进行反应,与上述实验相比,所放出的热量_______(填“不变”“偏高"或“偏低”)。
(4)上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是________(填字母)。
a. 实验装置保温、隔热效果差
b. 用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c. 分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d. 将以上四实验测量温度均纳入计算平均值