题目内容
12.对于下列反应:A(g)+3B(g)?2C(g),如果2min内B的浓度由8mol/L下降为2mol/L,那么,用B的浓度变化表示的化学反应速率为3mol•L-1•min-1;若在一定温度下该反应达到平衡,则其平衡常数表达式为$\frac{{c}^{2}(C)}{c(A){c}^{3}(B)}$;若各物质的平衡浓度分别为C(A)=3mol/L、C(B)=2mol/L、C(C)=1mol/L,则K=$\frac{1}{24}$.分析 根据V=$\frac{△c}{△t}$计算反应速率,根据平衡常数为生成物浓度的幂次方之积除以反应物浓度的幂次方之积,据此计算.
解答 解:v(B)=$\frac{△c}{△t}$=$\frac{8mol/L-2mol/L}{2min}$=3mol•L-1•min-1;
A(g)+3B(g)?2C(g)中平衡常数表达式为K=$\frac{{c}^{2}(C)}{c(A){c}^{3}(B)}$,若各物质的平衡浓度分别为C(A)=3mol/L、C(B)=2mol/L、C(C)=1mol/L,则K=$\frac{{1}^{2}}{3×{2}^{3}}$=$\frac{1}{24}$,
故答案为,3mol•L-1•min-1;K=$\frac{{c}^{2}(C)}{c(A){c}^{3}(B)}$;$\frac{1}{24}$.
点评 本题考查化学反应速率以及平衡常数的相关计算,难度不大.要注意根据公式进行计算即可.

练习册系列答案
相关题目
18.在恒温恒容的容器中进行反应H2?2H;△H>0,若反应物浓度由0.1mol•L-1降到0.06mol•L-1需20s,那么由0.06mol•L-1降到0.024mol•L-1需要的反应时间为( )
| A. | 等于18s | B. | 等于 12s | C. | 大于18s | D. | 小于18s |
3. (1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示可逆反应进行的程度越大,K值大小与温度的关系是:温度升高,K值不确定(填“增大”“减小”“不确定”).
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示可逆反应进行的程度越大,K值大小与温度的关系是:温度升高,K值不确定(填“增大”“减小”“不确定”).
(2)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H=-QkJ/mol (Q>0),CO和H2O浓度变化如图.
T℃时物质浓度(mol•L-1)的变化:
在T℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如表.
①表中c1数值大于0.08mol/L (填大于、小于或等于).
②反应在4min~5min之间,平衡向逆方向移动,可能的原因是d,表中5min~6min之间数值发生变化,可能的原因是a.
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
(3)现有T℃时的密闭容器中存在如下反应:2SO2 (g)+O2(g)?2SO3(g)△H<0.
已知:反应开始时c(SO2)=0.4mol/L,c(O2)=1mol/L,经测定该反应在该温度下的平衡常数K≈19,试判断:当反应进行到SO2转化率为50%时,该反应是否达到平衡状态未达平衡(填“平衡状态”或“未达平衡”),理由是因为浓度商Qc=1.1≠19,所以未达到平衡;若未达到平衡状态,该反应此时向正方向进行.(填“正向”或“逆向”)
 (1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示可逆反应进行的程度越大,K值大小与温度的关系是:温度升高,K值不确定(填“增大”“减小”“不确定”).
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示可逆反应进行的程度越大,K值大小与温度的关系是:温度升高,K值不确定(填“增大”“减小”“不确定”).(2)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H=-QkJ/mol (Q>0),CO和H2O浓度变化如图.
T℃时物质浓度(mol•L-1)的变化:
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
①表中c1数值大于0.08mol/L (填大于、小于或等于).
②反应在4min~5min之间,平衡向逆方向移动,可能的原因是d,表中5min~6min之间数值发生变化,可能的原因是a.
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
(3)现有T℃时的密闭容器中存在如下反应:2SO2 (g)+O2(g)?2SO3(g)△H<0.
已知:反应开始时c(SO2)=0.4mol/L,c(O2)=1mol/L,经测定该反应在该温度下的平衡常数K≈19,试判断:当反应进行到SO2转化率为50%时,该反应是否达到平衡状态未达平衡(填“平衡状态”或“未达平衡”),理由是因为浓度商Qc=1.1≠19,所以未达到平衡;若未达到平衡状态,该反应此时向正方向进行.(填“正向”或“逆向”)
20.维生素C不具有的性质是( )
| A. | 难溶于水 | B. | 易溶于水 | C. | 强还原性 | D. | 酸性 |
7.在恒温、恒容的密闭容器中反应.若反应物的浓度由2mol/L降到0.8mol/L需20s,那么反应物浓度由2mol/L降到1.4mol/L所需的时间( )
| A. | 10s | B. | 大于10s | C. | 小于10s | D. | 无法判断 |
17.下列说法正确的是( )
| A. | HNO3的摩尔质量是63g | |
| B. | 硫酸和磷酸的摩尔质量相等,都是98g/mol | |
| C. | 摩尔质量等于物质的相对原子(分子)质量 | |
| D. | 摩尔质量就是物质相对原子(分子)质量的6.02×1023倍 |
4.如图所示装置中,a、b都是惰性电极,通电一段时间后,b极附近呈蓝色.下列说法正确的是( )
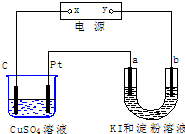

| A. | C是阳极,Pt是阴极 | |
| B. | x是负极,y是正极 | |
| C. | a极和Pt产生气体的物质的量相同 | |
| D. | CuSO4溶液pH值不变,U形管溶液pH值增大 |
2.CaH2常作生氢剂,其中氢元素的化合价是-1价,CaH2与水反应的化学方程式是CaH2+2H2O=Ca(OH)2+2H2↑,其中H2O是( )
| A. | 还原剂 | B. | 氧化剂 | ||
| C. | 既是氧化剂,又是还原剂 | D. | 既不是氧化剂,也不是还原剂 |