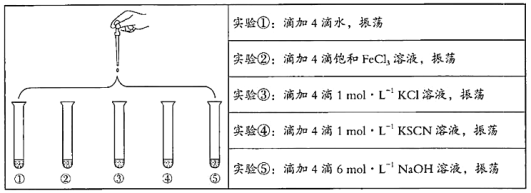
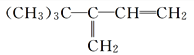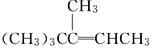题目内容
【题目】下表是元素周期表中短周期的一部分。已知A元素原子的最外层电子数比其电子层数的3倍还多。下列关于表中六种元素的说法正确的是 ( )
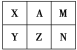
A. X的单质在空气中可以燃烧
B. X、Y、Z三种元素中Y元素形成的单核阴离子半径最大
C. 最高价氧化物对应的水化物酸性最强的是A元素
D. A单质通入NaZ溶液中,根据反应现象可证明A、Z非金属性的相对强弱
【答案】B
【解析】
由短周期元素在周期表的位置可知,A为第二周期元素,A元素原子的最外层电子数比其电子层数的3倍还多,A的电子层数为2,最外层电子数为7,A应为F元素,则X为O元素,M为Ne元素,Y为S元素,Z为Cl元素,N为Ar元素,结合元素对应的单质、化合物的性质以及元素周期律的递变规律解答该题。
由上述分析可知,X为O,A为F,M为Ne,Y为S,Z为Cl,N为Ar,则
A.氧元素的单质不能燃烧,为助燃剂,A错误;
B.电子层越多,离子半径越大,具有相同电子排布的离子中原子序数大的离子半径小,则X、Y、Z三种元素中S元素形成的单核阴离子半径最大,B正确;
C.O、F无正价,最高价氧化物对应的水化物酸性最强的是Cl元素,C错误;
D.氟气通入NaCl溶液中,F2与水反应生成HF与O2,不能置换出氯,不能证明F、Cl非金属性的相对强弱,D错误;
答案选B。

 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案【题目】Ⅰ.有机物X是一种重要的有机合成中间体,用于制造塑料、涂料和黏合剂等高聚物。为研究X的组成与结构,进行了如下实验:
(1)有机物X的质谱图为: | |
| 有机物X的相对分子质量是________。 |
(2)将10.0 g X在足量O2中充分燃烧,并使其产物依次通过足量的无水CaCl2和KOH浓溶液,发现无水CaCl2增重7.2 g,KOH浓溶液增重22.0 g。 | 有机物X的分子式是______。 |
(3)经红外光谱测定,有机物X中含有醛基;有机物X的核磁共振氢谱图上有2个吸收峰,峰面积之比是3∶1。 | 有机物X的结构简式是__________。 |
II.写出与![]() 互为同分异构体,且一溴代物只有两种的芳香烃的结构简式和名称:________________、___________。
互为同分异构体,且一溴代物只有两种的芳香烃的结构简式和名称:________________、___________。