题目内容
铁镍蓄电池又称爱迪生电池,放电时的总反应为Fe+Ni2O3+3H2O===Fe(OH)2+2Ni(OH)2下列有关该电池的说法不正确的是 ( )
| A.电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe |
| B.电池放电时,负极反应为Fe+2OH--2e-===Fe(OH)2 |
| C.电池充电过程中,阴极附近溶液的pH降低 |
| D.电池充电时,阳极反应为2Ni(OH)2+2OH--2e-===Ni2O3+3H2O |
C
解析试题分析:A.电池的电解液为碱性溶液,氧化性物质Ni2O3为正极、活泼金属Fe为负极,正确;B.电池放电时,负极反应为Fe+2OH--2e-===Fe(OH)2,正确;C.电池充电过程中,原电池是负极变为阴极,Fe(OH)2+2e-===Fe+2OH-,附近溶液的pH升高,故原说法错误;D.电池充电时,阳极反应是原电池的正极反应的逆反应,故为2Ni(OH)2+2OH--2e-===Ni2O3+3H2O,正确。
考点:考查二次电池的充、放电原理。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
如图所示,a、b是多孔石墨电极,某同学按图示装置进行如下实验: 断开K2,闭合K1一段时间,观察到两支玻璃管内都有气泡将电极包围,此时断开K1,闭合K2,观察到电流计A的指针有偏转。下列说法不正确的是
| A.断开K2,闭合K1一段时间,溶液的pH变大 |
| B.断开K1,闭合K2时,b极上的电极反应式为:2H++2e-====H2↑ |
| C.断开K2,闭合K1时,a极上的电极反应式为:4OH--4e-====O2↑+2H2O |
| D.断开K1,闭合K2时,OH-向b极移动 |
对于锌、铜和稀硫酸组成的原电池(如下图),下列有关说法错误的是
| A.溶液中H+向负极移动 | B.电子由Zn经外电路流向Cu |
| C.Zn电极反应:Zn-2e-=Zn2+ | D.Cu是正极 |
锌片和碳棒用导线连接后插入稀硫酸中,锌片是
| A.阴极 | B.正极 | C.阳极 | D.负极 |
我们生活中离不开各种各样的电池,下列关于电池的说法错误的是( )
| A.用后不能再生的电池称为一次电池,如锌锰干电池(电解质溶液中含氯化铵等) |
| B.放电后通过充电可反复使用的电池称为二次电池,如镍镉电池、铅蓄电池等 |
| C.手机、电脑、数码相机中的可充电电池使用寿命长,对环境无害,不用进行回收 |
| D.目前我国生产的无汞干电池,对环境和人体健康没有明显危害,可以不进行特殊处理,和普通垃圾混放 |
将纯锌片和纯铜片按图方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是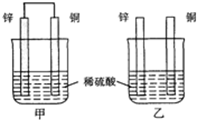
| A.两烧杯中溶液的pH均增大 |
| B.甲中铜片是正极,乙中铜片是负极 |
| C.两烧杯中铜片表面均无气泡产生 |
| D.甲、乙溶液均变蓝色 |
某小组为研究电化学原理,设计如图装置。下列叙述不正确的是( )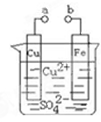
| A.a和b不连接时,铁片上会有金属铜析出 |
| B.a和b用导线连接时,铜片上发生的反应为:Cu2++2e-= Cu |
| C.无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色 |
| D.a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动 |
如将两个铂电极插入KOH溶液中,向两极分别通入CH4和O2即构成甲烷燃料电池。已知通入甲烷的一极,其电极反应为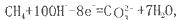 ,下列叙述正确的是
,下列叙述正确的是
| A.通入甲烷的一极为正极 |
| B.通入氧气的一极发生氧化反应 |
C.该电池总反应为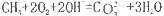 |
| D.该电池在工作时,溶液中的阴离子向正极移动 |
人造地球卫星用的一种高能电池——银锌电池,该电池的电极反应式为:
Zn+2OH- -2e- = ZnO+H2O;Ag2O+H2O+2e-=2Ag+2OH-,据此判断氧化银是( )
| A.负极,并被氧化 | B.正极,并被还原 |
| C.负极,并被还原 | D.正极,并被氧化 |