题目内容
【题目】甲醇是一种重要的化工原料,在化工领域有广泛应用。
(1)甲醇燃料电池由于结构简单、能量转化率高、对环境天污染,可作为常规能源的替代品而越来越受到关注。其工作原理如如图所示:
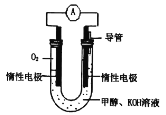
①该电池正极的电极反应为___,放电过程中负极区域溶液的pH值___(填“变大”或“变小”或“不变”)。
②该电池总反应的化学方程式为___。
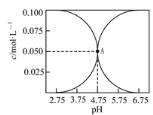
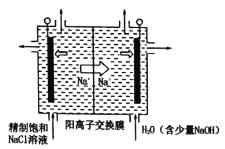
(2)二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高校、光谱、安全的杀菌消毒剂。目前已开发出用电解法制取ClO2的新工艺。
①如图中用石墨作电极,在一定条件下电解饱和食盐水制取ClO2。则阳极产生ClO2的电极反应式为____。
②电解一段时间,当阴极产生的气体体积为112mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为___mol。
(3)英国《自然》杂志近期报道了一种新型铝离子电池,以金属铝和石墨为电极,用A1Cl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示。
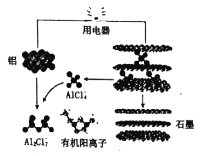
①电池放电时负极的电极反应式为___。
②充电时有机阳离子向___电极移动(填“铝”或“石墨”)。
③电池充电时,电路中每转移0.15mol电子,理论上生成___g铝。
【答案】O2+4e-+2H2O=4OH- 变小 2CH3OH+3O2+4OH-=2CO32-+6H2O Cl--5e-+2H2O=ClO2+4H+ 0.01 Al-3e-+7A1Cl4-=4A12Cl7- 铝 1.35
【解析】
(1)①原电池中的氧气得电子,与溶液中的水反应生成氢氧根离子,作电池的正极;负极上甲醇失电子,与溶液中的氢氧根离子反应生成碳酸根离子和水;
②该电池总反应为甲醇、氧气与溶液中的氢氧根离子反应生成碳酸根离子和水;
(2)①阳极上的氯离子失电子,与溶液中的水反应生成ClO2和氢离子;
②阴极水电离产生的氢离子得电子,生成氢气;
(3)①根据图像可知,放电时,负极的Al失电子与A1Cl4-结合生成A12Cl7-;
②充电时,Al电极为阴极,有机阳离子向阴极移动;
③电池充电时,4A12Cl7-+3e-=Al+7A1Cl4-。
(1)①原电池中的氧气得电子,与溶液中的水反应生成氢氧根离子,作电池的正极,电极反应式为O2+4e-+2H2O=4OH-;负极上甲醇失电子,与溶液中的氢氧根离子反应生成碳酸根离子和水,则pH变小;
②该电池总反应为甲醇、氧气与溶液中的氢氧根离子反应生成碳酸根离子和水,方程式为2CH3OH+3O2+4OH-=2CO32-+6H2O;
(2)①阳极上的氯离子失电子,与溶液中的水反应生成ClO2和氢离子,电极方程式为Cl--5e-+2H2O=ClO2+4H+;
②阴极水电离产生的氢离子得电子,生成氢气,生成标况下的112mL氢气即0.005mol时,转移0.01mol电子,通过阳离子交换膜的阳离子的物质的量为0.01mol;
(3)①根据图像可知,放电时,负极的Al失电子与A1Cl4-结合生成A12Cl7-,则电极反应式为Al-3e-+7A1Cl4-=4A12Cl7-;
②充电时,Al电极为阴极,有机阳离子向阴极移动,即铝电极;
③电池充电时,4A12Cl7-+3e-=Al+7A1Cl4-,转移3mol电子,生成1molAl,则电路中每转移0.15mol电子,生成0.05mol铝,即1.35g。