题目内容
17.有一种生产碘的方法是用Na2SO3还原碘酸盐(IO3-),每还原出2mol I2,理论上需用去Na2SO3( )| A. | 2mol | B. | 4mol | C. | 5mol | D. | 10mol |
分析 反应中Na2SO3被氧化为Na2SO4,硫元素化合价由+4价升高为+6价,I元素由+5价降低为0价,再根据电子转移守恒计算.
解答 解:反应中Na2SO3被氧化为Na2SO4,硫元素化合价由+4价升高为+6价,I元素由+5价降低为0价,根据电子转移守恒:2mol×2×(5-0)=n(Na2SO3)×(6-4),解得n(Na2SO3)=10mol,
故选:D.
点评 本题考查氧化还原反应计算,难度不大,注意理解掌握氧化还原反应计算中电子转移守恒应用.

练习册系列答案
 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案
相关题目
7.下列反应完成后没有沉淀的是( )
| A. | BaCl2溶液与Na2CO3溶液反应后加足量稀H2SO4 | |
| B. | Ba(OH)2溶液与KNO3溶液反应后加足量稀H2SO4 | |
| C. | AgNO3溶液与Na2CO3溶液反应后加足量稀HCl | |
| D. | Ca(OH)2溶液与FeCl3溶液反应后加足量稀HNO3 |
8.下列化学反应的离子方程式不正确的是( )
| A. | 铁屑溶于过量稀硝酸:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | |
| B. | Fe(OH)3溶于过量的HI溶液:2Fe(OH)3+6H++2I-═2Fe2++I2+6H2O | |
| C. | 在AlCl3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 过量的NaHSO4溶液与Ba(OH)2溶液反应:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O |
5.下列反应的离子方程式,正确的是( )
| A. | 石灰水中通入过量的CO2:CO2+Ca2++2OH-═CaCO3↓+H2O | |
| B. | 稀硫酸和氢氧化钡:Ba2++SO42-═BaSO4↓ | |
| C. | 碳酸氢钠和烧碱溶液:HCO3-+OH-═CO32-+H2O | |
| D. | 氯化铁溶液和氨水:Fe3++3OH-═Fe(OH)3↓ |
9.下列操作中错误的是( )
| A. | 溴苯中含有溴单质,可用NaOH溶液洗涤,再经分液而除去 | |
| B. | 除去苯中的少量苯酚:加入NaOH溶液、振荡、静置分层后,除去水层 | |
| C. | 除去乙酸乙酯中少量的乙酸:加入乙醇和浓硫酸,使乙酸全部转化为乙酸乙酯 | |
| D. | 用CuSO4溶液和过量NaOH溶液混合,然后加入几滴乙醛,加热煮沸观察红色沉淀 |
6.将0.1mol•L-1的氨水加水稀释10倍,下列数据逐渐增大的是( )
| A. | n (NH3•H2O) | B. | n (OH-) | C. | c (NH3•H2O) | D. | c (NH4+) |
7.下列各种粒子,在氧化还原反应中通常只可作为氧化剂使用的是( )
| A. | SO32- | B. | MnO4- | C. | Cl- | D. | Fe |

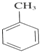 +3HNO3$\stackrel{浓硫酸}{→}$
+3HNO3$\stackrel{浓硫酸}{→}$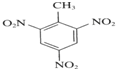 +3H2O.
+3H2O.