题目内容
6.将0.1mol•L-1的氨水加水稀释10倍,下列数据逐渐增大的是( )| A. | n (NH3•H2O) | B. | n (OH-) | C. | c (NH3•H2O) | D. | c (NH4+) |
分析 一水合氨是弱电解质,在水溶液中存在电离平衡,加水稀释促进一水合氨电离,但氢氧根离子和铵根离子物质的量增大的幅度不如溶液体积增大的幅度大,其浓度减小,据此分析解答.
解答 解:一水合氨是弱电解质,在水溶液中存在电离平衡,加水稀释促进一水合氨电离,所以n(NH3•H2O)减小,n (OH-)增大,氢氧根离子和铵根离子物质的量增大的幅度不如溶液体积增大的幅度大,其浓度减小,
故选B.
点评 本题考查弱电解质的电离,注意弱电解质的电离程度与溶液浓度成反比,为易错点,题目难度不大.

练习册系列答案
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案
相关题目
16.下列反应的离子方程式书写正确的是( )
| A. | 氯化铜溶液与铁粉反应:3Cu2++2Fe=2Fe3++3Cu | |
| B. | 碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑ | |
| C. | 稀 H2SO4与铁粉反应:Fe+2H+=Fe2++H2↑ | |
| D. | 氢氧化钡溶液与稀 H2SO4 反应:Ba2++SO42-=BaSO4↓ |
17.有一种生产碘的方法是用Na2SO3还原碘酸盐(IO3-),每还原出2mol I2,理论上需用去Na2SO3( )
| A. | 2mol | B. | 4mol | C. | 5mol | D. | 10mol |
11.关于CH3COOH溶液的电离平衡:CH3COOH?CH3COO-+H+,下列叙述正确的是( )
| A. | 加入少量NaOH固体,平衡正向移动 | |
| B. | 升温,平衡逆向移动,c(CH3COO-)减小 | |
| C. | 加入少量CH3COONa固体,平衡正向移动 | |
| D. | 通入少量HCl气体,平衡逆向移动,c(H+)减小 |
15.下列物质分类正确的是( )
| A. | SO2、SiO2、CO均为酸性氧化物 | |
| B. | Cu、NaCl、CaO在熔融状态下均能导电 | |
| C. | 烧碱、硫酸、四氯化碳均为电解质 | |
| D. | 稀豆浆、牛奶、氯化铁溶液均为胶体 |
16.与100mL 0.5mol/L氯化铝溶液中的氯离子物质的量浓度相等的溶液是( )
| A. | 50mL 1.5mol/L的KCl溶液 | B. | 50mL 1.5mol/L的KClO3溶液 | ||
| C. | 100mL 1mol/L的MgCl溶液 | D. | 450mL 0.5mol/的NaCl溶液 |

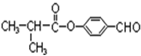 .
.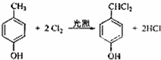 .
. .
.
