题目内容
Ⅰ、在一定温度下,氧化铁可以与一氧化碳发生反应:
Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g).已知该反应在不同温度下的平衡常数如下表:
请回答下列问题:
该反应的平衡常数表达式K=
Ⅱ、工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41kJ/mol
某小组研究在相同温度下该反应过程中的能量变化.他们分别在体积均为V L的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应.相关数据如下:
(1)容器①中反应达平衡时,CO的转化率为
(2)计算容器②中反应的平衡常数K=
(3)下列叙述正确的是
a.平衡时,两容器中H2的体积分数相等
b.容器②中反应达平衡状态时,Q>65.6kJ
c.反应开始时,两容器中反应的化学反应速率相等
d.容器①中,化学反应速率为:v(H2O)=
mol/(L?min)
Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g).已知该反应在不同温度下的平衡常数如下表:
| 温度/℃ | 1 000 | 1 150 | 1 300 |
| 平衡常数 | 64.0 | 50.7 | 42.9 |
该反应的平衡常数表达式K=
K=
| c3(CO3) |
| c3(CO) |
K=
,△H| c3(CO3) |
| c3(CO) |
<
<
0(填“>”、“<”或“=”).Ⅱ、工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41kJ/mol
某小组研究在相同温度下该反应过程中的能量变化.他们分别在体积均为V L的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应.相关数据如下:
| 容器编号 | 起始时各物质物质的量/mol | 达到平衡的时间/min | 达平衡时体系能量的变化/kJ | ||||
| CO | H2O | CO2 | H2 | ||||
| ① | 1 | 4 | 0 | 0 | t1 | 放出热量:32.8kJ | |
| ② | 2 | 8 | 0 | 0 | t2 | 放出热量:Q | |
80%
80%
.(2)计算容器②中反应的平衡常数K=
1
1
.(3)下列叙述正确的是
a
a
(填字母序号).a.平衡时,两容器中H2的体积分数相等
b.容器②中反应达平衡状态时,Q>65.6kJ
c.反应开始时,两容器中反应的化学反应速率相等
d.容器①中,化学反应速率为:v(H2O)=
| 4 |
| Vt1 |
分析:Ⅰ、根据化学平衡常数的表达式完成,注意固体在平衡常数中不表示;根据表中温度升高,平衡常数的变化判断焓变;
Ⅱ、(,1)依据反应①热量变化结合热化学方程式计算消耗一氧化碳物质的量计算转化率;
(2)反应②和反应①在相同温度下进行,平衡常数不变,依据化学平衡三段式计算平衡浓度,结合平衡常数概念计算得到;
(3)a、反应前后气体体积不变,反应①②是相同平衡分析判断;
b、反应是可逆反应不能进行彻底;
c、反应起始浓度不同反应速率不同;
d、反应速率是单位时间内反应物浓度减小计算得到.
Ⅱ、(,1)依据反应①热量变化结合热化学方程式计算消耗一氧化碳物质的量计算转化率;
(2)反应②和反应①在相同温度下进行,平衡常数不变,依据化学平衡三段式计算平衡浓度,结合平衡常数概念计算得到;
(3)a、反应前后气体体积不变,反应①②是相同平衡分析判断;
b、反应是可逆反应不能进行彻底;
c、反应起始浓度不同反应速率不同;
d、反应速率是单位时间内反应物浓度减小计算得到.
解答:解:Ⅰ、在一定温度下,氧化铁可以与一氧化碳发生反应:Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g),该反应的平衡常数表达式为:K=
;
从表中数据可知,温度升高,平衡常数减小,说明化学平衡向着逆向移动,正反应为放热反应,△H<0,
故答案为:K=
;<;
Ⅱ、(1)依据反应①热化学方程式计算,
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41kJ/mol
起始量(mol) 1 4 0 0 41KJ
变化量(mol) 0.8 0.8 0.8 0.8 32.8KJ
平衡量(mol)0.2 3.2 0.8 0.8
一氧化碳平衡转化率=
×100%=80%,
故答案为:80;
(2)反应①②在相同温度下进行,平衡常数相同,依据(2)结合平衡常数概念计算=
=
=1,
故答案为:1;
(3)a、反应前后气体体积不变,反应①②是相同平衡,平衡时,两容器中H2的体积分数相等,故a正确;
b、反应是可逆反应不能进行彻底,容器②中反应达平衡状态时,Q=65.6kJ;故b错误;
c、反应起始浓度不同,反应速率不同,故c错误;
d、反应速率是单位时间内反应物浓度减小计算,容器①中,反应的化学反应速率为v(H2O)=
=
mol/L?min,故d错误;
故答案为:a.
| c3(CO3) |
| c3(CO) |
从表中数据可知,温度升高,平衡常数减小,说明化学平衡向着逆向移动,正反应为放热反应,△H<0,
故答案为:K=
| c3(CO3) |
| c3(CO) |
Ⅱ、(1)依据反应①热化学方程式计算,
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41kJ/mol
起始量(mol) 1 4 0 0 41KJ
变化量(mol) 0.8 0.8 0.8 0.8 32.8KJ
平衡量(mol)0.2 3.2 0.8 0.8
一氧化碳平衡转化率=
| 0.8mol |
| 1mol |
故答案为:80;
(2)反应①②在相同温度下进行,平衡常数相同,依据(2)结合平衡常数概念计算=
| c(CO2)?c(H2) |
| c(CO)c(H2O) |
| ||||
|
故答案为:1;
(3)a、反应前后气体体积不变,反应①②是相同平衡,平衡时,两容器中H2的体积分数相等,故a正确;
b、反应是可逆反应不能进行彻底,容器②中反应达平衡状态时,Q=65.6kJ;故b错误;
c、反应起始浓度不同,反应速率不同,故c错误;
d、反应速率是单位时间内反应物浓度减小计算,容器①中,反应的化学反应速率为v(H2O)=
| ||
| t1min |
| 0.8 |
| Vt1 |
故答案为:a.
点评:本题考查反应能量变化,盖斯定律计算应用,化学平衡的影响因素分析判断,题目难度中等,平衡判断和平衡常数的计算是解题关键,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案
相关题目
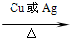 2CH3CHO+2H2O
2CH3CHO+2H2O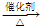
 ,
, CH3COOC2H5+H2O,
CH3COOC2H5+H2O, (2009?安徽模拟)A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素原子的电子层数为n,最外层电子数为2n+1,A、B、C、E每种元素都能与D元素组成两种或两种以上的常见化合物.回答下列问题:
(2009?安徽模拟)A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素原子的电子层数为n,最外层电子数为2n+1,A、B、C、E每种元素都能与D元素组成两种或两种以上的常见化合物.回答下列问题:
 .已知N-N键键能为167kJ?mol-1,NO2中氮氧键的键能为466kJ?mol-1,N2O4中氮氧键的键能为438.5kJ?mol-1.请写出NO2转化为N2O4的热化学方程式为
.已知N-N键键能为167kJ?mol-1,NO2中氮氧键的键能为466kJ?mol-1,N2O4中氮氧键的键能为438.5kJ?mol-1.请写出NO2转化为N2O4的热化学方程式为