题目内容
(1)未用食用油炒咸菜的铁锅如果没有洗净,不久会出现红褐色锈斑.则铁锅的锈蚀属于(2)氯化铁水溶液呈
(3)在一定温度下,有a.盐酸 b.硫酸 c.醋酸三种酸(以下填空分别用a、b、c表示)
①当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是
②同体积、同物质的量浓度的三种酸,中和NaOH的能力由大到小的顺序是
③当三者c(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序是
分析:(1)中性或弱酸性条件下,钢铁发生吸氧腐蚀;铁、碳和电解质溶液构成原电池,铁易失电子作负极,碳作正极,正极上氧气得电子发生还原反应;
(2)氯化铁是强酸弱碱盐,铁离子在水溶液中水解显酸性;FeCl3溶液蒸干,水解生成的氯化氢挥发促进水解平衡正向进行,得到水解产物氢氧化铁,灼烧氢氧化铁分解生成氧化铁;实验室在配制FeCl3的溶液时,常将FeCl3固体先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度,防止铁离子水解;
(3)①硫酸为二元酸,盐酸为一元强酸,醋酸为弱酸;
②同体积同物质的量浓度的三种酸,醋酸和盐酸的物质的量相等,但硫酸为二元酸;
③当c(H+)相同、体积相同时,盐酸、硫酸完全电离,只有醋酸在继续电离;
(2)氯化铁是强酸弱碱盐,铁离子在水溶液中水解显酸性;FeCl3溶液蒸干,水解生成的氯化氢挥发促进水解平衡正向进行,得到水解产物氢氧化铁,灼烧氢氧化铁分解生成氧化铁;实验室在配制FeCl3的溶液时,常将FeCl3固体先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度,防止铁离子水解;
(3)①硫酸为二元酸,盐酸为一元强酸,醋酸为弱酸;
②同体积同物质的量浓度的三种酸,醋酸和盐酸的物质的量相等,但硫酸为二元酸;
③当c(H+)相同、体积相同时,盐酸、硫酸完全电离,只有醋酸在继续电离;
解答:解:(1)弱酸或中性条件下,钢铁发生吸氧腐蚀,铁、碳和电解质溶液构成原电池,铁作负极,碳作正极,正极上氧气得电子发生还原反应,电极反应式为:2H2O+O2+4e-=4OH-;
故答案为:吸氧,O2+2H2O+4e-=4OH-;
(2)氯化铁是强酸弱碱盐,铁离子在水溶液中水解显酸性,水解离子方程式为:Fe3++3H2O?Fe(OH)3+3H+,FeCl3溶液蒸干,水解生成的氯化氢挥发,促进水解平衡正向进行,得到水解产物氢氧化铁,灼烧氢氧化铁分解生成氧化铁;实验室在配制FeCl3的溶液时,为抑制铁离子的水解,常将FeCl3固体先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度;
故答案为:酸性,Fe3++3H2O?Fe(OH)3+3H+,Fe2O3,浓盐酸;
(3)①硫酸为二元酸,盐酸为强酸,醋酸为弱酸,则质的量浓度相同时,c(H+)由大到小的顺序是b>a>c;
故答案为:b>a>c;
②同体积同物质的量浓度的三种酸,醋酸和盐酸的物质的量相等,但硫酸为二元酸,则中和同物质的量浓度的NaOH消耗的体积由大到小的顺序是b>a=c;
故答案为:b>a=c;
③当c(H+)相同、体积相同时,盐酸、硫酸完全电离,只有醋酸在继续电离,则分别加入足量锌,相同状况产生的气体体积由大到小的顺序为c>a=b;
故答案为:c>a=b;
故答案为:吸氧,O2+2H2O+4e-=4OH-;
(2)氯化铁是强酸弱碱盐,铁离子在水溶液中水解显酸性,水解离子方程式为:Fe3++3H2O?Fe(OH)3+3H+,FeCl3溶液蒸干,水解生成的氯化氢挥发,促进水解平衡正向进行,得到水解产物氢氧化铁,灼烧氢氧化铁分解生成氧化铁;实验室在配制FeCl3的溶液时,为抑制铁离子的水解,常将FeCl3固体先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度;
故答案为:酸性,Fe3++3H2O?Fe(OH)3+3H+,Fe2O3,浓盐酸;
(3)①硫酸为二元酸,盐酸为强酸,醋酸为弱酸,则质的量浓度相同时,c(H+)由大到小的顺序是b>a>c;
故答案为:b>a>c;
②同体积同物质的量浓度的三种酸,醋酸和盐酸的物质的量相等,但硫酸为二元酸,则中和同物质的量浓度的NaOH消耗的体积由大到小的顺序是b>a=c;
故答案为:b>a=c;
③当c(H+)相同、体积相同时,盐酸、硫酸完全电离,只有醋酸在继续电离,则分别加入足量锌,相同状况产生的气体体积由大到小的顺序为c>a=b;
故答案为:c>a=b;
点评:本题考查了盐类水解的分析应用,金属腐蚀的原理分析判断,弱电解质的电离平衡,明确弱电解质电离特点是解本题关键,注意不同的酸与相同金属反应时,反应速率与氢离子浓度有关,与电解质强弱无关,题目难度中等.

练习册系列答案
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案
相关题目
 (1)未用食用油炒咸菜的铁锅如果没有洗净,不久会出现红褐色锈斑.则铁锅的锈蚀属于
(1)未用食用油炒咸菜的铁锅如果没有洗净,不久会出现红褐色锈斑.则铁锅的锈蚀属于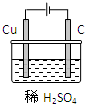
 CuSO4+H2↑请在右边方框中画出能够实验这一反应的装置图(作必要的标注);某同学做该实验时,看到碳棒上有气泡产生,铜棒上气泡更多且没有被腐蚀,其原因是 。
CuSO4+H2↑请在右边方框中画出能够实验这一反应的装置图(作必要的标注);某同学做该实验时,看到碳棒上有气泡产生,铜棒上气泡更多且没有被腐蚀,其原因是 。
 CuSO4+H2↑请在右边方框中画出能够实验这一反应的装置图(作必要的标注);某同学做该实验时,看到碳棒上有气泡产生,铜棒上气泡更多且没有被腐蚀,其原因是 。
CuSO4+H2↑请在右边方框中画出能够实验这一反应的装置图(作必要的标注);某同学做该实验时,看到碳棒上有气泡产生,铜棒上气泡更多且没有被腐蚀,其原因是 。
 常条件下不能发生的反应:Cu+H2SO4(稀)=CuSO4+H2↑。
常条件下不能发生的反应:Cu+H2SO4(稀)=CuSO4+H2↑。