题目内容
在容积为2 L的恒容的密闭容器中,一定温度下,发生反应:aM(g)+bN(g) cQ(g)。气体M、N、Q的物质的量随时间的变化如图所示,则下列叙述正确的是( )
cQ(g)。气体M、N、Q的物质的量随时间的变化如图所示,则下列叙述正确的是( )
| A.该温度下此反应的平衡常数的值K=25/4 |
| B.该反应前5 min的平均速率:v(N)=0.002 mol·L-1·min-1 |
| C.在5 min时,再向体系中充入少量He,重新达到平衡前v(正)>v(逆) |
| D.若开始时向容器中充入2mol M和1mol N,达到平衡时,M的体积分数小于50% |
D
解析试题分析:A、根据图像可知,平衡时M、N、Q的物质的量分别变化了0.4mol、0.2mol、0.2mol,根据变化量之比是相应的化学计量数之比可知,该反应的化学方程式为2M(g)+N(g) Q(g)。平衡时M、N、Q的物质的量浓度分别为0.2mol/L、0.1mol/L、0.1mol/L,所以该温度下平衡常数K=
Q(g)。平衡时M、N、Q的物质的量浓度分别为0.2mol/L、0.1mol/L、0.1mol/L,所以该温度下平衡常数K= =25,A不正确;B、该反应前5 min的平均速率:v(N)=0.1mol/L÷5min=0.02 mol·L-1·min-1,B不正确;C、容器容积不变,则加入He气,物质的浓度不变,因此反应速率不变,平衡不变,C不正确;D、若开始时向容器中充入2mol M和1mol N,则相当于是降低压强,平衡向逆反应方向移动,所以达到平衡时,M的体积分数小于
=25,A不正确;B、该反应前5 min的平均速率:v(N)=0.1mol/L÷5min=0.02 mol·L-1·min-1,B不正确;C、容器容积不变,则加入He气,物质的浓度不变,因此反应速率不变,平衡不变,C不正确;D、若开始时向容器中充入2mol M和1mol N,则相当于是降低压强,平衡向逆反应方向移动,所以达到平衡时,M的体积分数小于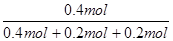 ×100%=50%,D正确,答案选D。
×100%=50%,D正确,答案选D。
考点:考查可逆反应的有关计算与判断

在一不可变容器中发生如下反应:2NO2 2NO + O2 ΔH >0 达到平衡后,升温,混合气体的( )不变
2NO + O2 ΔH >0 达到平衡后,升温,混合气体的( )不变
| A.密度 | B.颜色 | C.压强 | D.总物质的量 |
纳米是长度单位,1纳米等于1×10-9米,物质的颗粒达到纳米级时,具有特殊的性质。例如将单质铜制成“纳米铜”时,具有非常强的化学活性,在空气中可以燃烧。下列对“纳米铜” 的有关叙述正确的是( )
| A.常温下“纳米铜”比铜片的还原性强,反应时反应速率快 |
| B.“纳米铜”颗粒更细小,化学反应时接触面大,所以反应速率快 |
| C.“纳米铜”与铜是同素异形体 |
| D.常温下“纳米铜”比铜片更易得电子,反应时反应速率快 |
下列说法正确的是( )
| A.增大压强,化学反应速率一定增大 |
| B.化学反应速率为反应时间内反应物浓度的增加或者生成物浓度的减少 |
| C.升高温度,化学反应速率一定增大 |
| D.加入反应物,化学反应速率增大 |
在2L恒容密闭容器中充入2 mol X和lmol Y发生反应:2X(g)+Y(g) 3Z(g)△H<0, 反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是
3Z(g)△H<0, 反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是
| A.升高温度,平衡常数增大 |
| B.W点X的正反应速率等于M点X的正反应速率 |
| C.Q点时,Y的转化率最大 |
| D.平衡时充入Z,达到新平衡时Z的体积分数比原平衡时大 |
将0.05molSO2(g)和0.03molO2(g)放入容积为1L的密闭容器中,反应2SO2(g)+O2(g)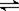 2SO3(g),在一定条件下达到平衡,测得c(SO3)=0.04mol·L-1。以下表述正确的是
2SO3(g),在一定条件下达到平衡,测得c(SO3)=0.04mol·L-1。以下表述正确的是
| A.该条件下反应的平衡常数为1.6×103 |
| B.通常情况下,该反应一定能自发进行 |
| C.题给条件下,O2的转化率是20% |
| D.当体系中SO2和SO3的速率之比是1:1时,则该反应达到化学平衡状态 |
 设计如图原电池,探究pH对AsO43-氧化性的影响。测得电压与pH的关系如图。下列有关叙述错误的是
设计如图原电池,探究pH对AsO43-氧化性的影响。测得电压与pH的关系如图。下列有关叙述错误的是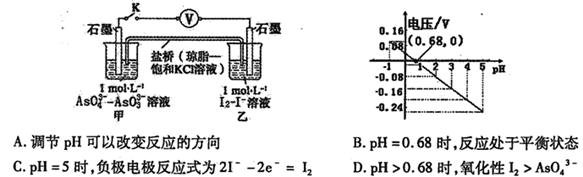
 zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是
zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是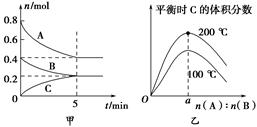
 2C,达到化学反应限度时,B的物质的量可能是( )
2C,达到化学反应限度时,B的物质的量可能是( )