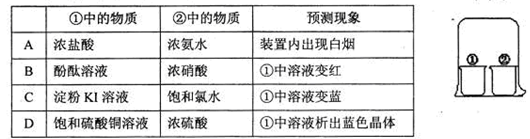
题目内容
下列说法正确的是
| A.高纯度的二氧化硅能用于制光导纤维,光导纤维遇强碱会“断路” |
| B.向氨水中滴加Al2(SO4)3溶液和向Al2(SO4)3溶液中滴加氨水,现象不同 |
| C.常温下,使湿润的KI淀粉试纸变蓝色的气体为氯气 |
| D.标准状况下,11.2LNO2和11.2LN2O4的混合物中所含的分子数为9.03×1023个 |
A
解析试题分析:A、二氧化硅可用于光导纤维,由于二氧化硅能和氢氧化钠溶液反应生成硅酸钠和水,因此光导纤维遇强碱会“断路”,A正确;B、氨水和硫酸铝反应生成硫酸铵和氢氧化铝白色沉淀。氢氧化铝是两性氢氧化物,但和氨水不反应,所以向氨水中滴加Al2(SO4)3溶液和向Al2(SO4)3溶液中滴加氨水,现象相同,B不正确;C、使湿润的KI淀粉试纸变蓝色的气体,说明该气体检验氧化性,能把碘化钾氧化生成单质碘,但气体不一定是氯气,C不正确;D、标准状况下,11.2LNO2和11.2LN2O4的物质的量分别是都是11.2L÷22.4L/mol=0.5mol,但由于存在平衡2NO2 N2O4,所以不能确定混合气的分子数,D不正确,答案选A。
N2O4,所以不能确定混合气的分子数,D不正确,答案选A。
考点:考查二氧化硅的性质与用途、氢氧化铝的制备、气体的检验以及物质的量的有关计算

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案
相关题目
某化学实验小组通过系列实验探究钠及其化合物的性质,下列实验操作及现象与预期 实验目的或实验结论不一致的是
| 选项 | 实验操作及现象 | 实验目的或结论 |
| A | 用洁净铂丝蘸取溶液进行焰色反应,火焰呈黄色 | 原溶液中有Na+无K+ |
| B | 在0.1 mol/L的NaHCO3溶液中,加2滴酚酞显浅红色,微热,溶液颜色加深 | 验证盐类水解反应是吸热反应 |
| C | 用镊子从煤油中取出金属钠,切下绿豆大小的钠块,用滤纸吸干钠块表面的煤油,小心放入装有苯和水的试管中,钠块在苯与水界面上下浮动 | 比较钠、水和苯三种物质的密度大小 |
| D | 向饱和Na2CO3溶液中通入足量CO2,溶液变浑浊 | NaHCO3的溶解度比Na2CO3的小 |
下列有关物质性质和应用的因果关系正确的是
| A.二氧化锰具有强氧化性,能将双氧水氧化为氧气 |
| B.浓硫酸具有较强酸性,能使Cu转化为Cu2+ |
| C.炭具有还原性,一定条件下能将二氧化硅还原为硅 |
| D.二氧化硫具有漂白性,所以与氯水混合使用效果更好 |
下列实验能很好达到预期目的的是
| A.向AlCl3溶液中加入NaOH溶液使铝离子恰好完全转化为Al(OH)3沉淀 |
| B.向AgCl悬浊液中加入KI溶液,沉淀由白色转化为黄色,证明溶解性AgI<AgCl |
| C.向试管中的银氨溶液滴加A物质,水浴加热,若产生银镜,说明A物质是醛类 |
| D.用湿润的pH试纸测试未知浓度盐酸的c(H+) |
下列关于元素及其化合物的说法正确的是
| A.Fe在常温下可与浓硝酸、稀硝酸、浓硫酸剧烈反应 |
| B.Na久置于空气中,可以和空气中的有关物质发生反应,最终生成NaHCO3 |
| C.S、Cl2均能和NaOH溶液发生氧化还原反应,且都既作氧化剂又作还原剂 |
| D.因为碳酸、氨水能够导电,所以液氨、二氧化碳是电解质 |
元素及其化合物丰富了物质世界,下列说法正确的是
| A.铜在冷的浓硫酸中会钝化,所以把铜放入冷的浓硫酸中无明显现象 |
| B.NaOH溶液和AlCl3溶液相互滴加的现象不同 |
| C.金属比非金属易失电子,所以金属可以置换非金属,而非金属不能置换金属 |
| D.Al、Fe、Cu三者对应的氧化物均为碱性氧化物 |
下列叙述正确的是
| A.NaHCO3固体中既含有离子键,又含有共价键,溶于水后的电离方程式为 NaHCO3=Na++H++CO32- |
B.符合a b b c转化关系的单质a可以是N2、Al、Si、S c转化关系的单质a可以是N2、Al、Si、S |
| C.室温下,pH=3的溶液中,Na+、Fe2+、NO3-、AlO2-四种离子不能大量共存 |
| D.用焰色反应或澄清石灰水均可鉴别Na2CO3与KHCO3溶液 |
下列图示与对应叙述相符合的是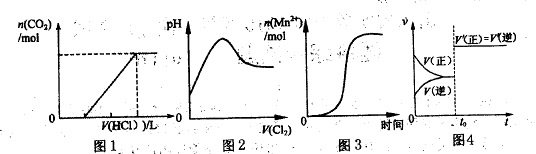
A.图1表示在含等物质的量NaOH、Na2CO3的混合溶液中滴加0.1mol 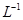 盐酸至过量时,产生气体的体积与消耗盐酸的关系 盐酸至过量时,产生气体的体积与消耗盐酸的关系 |
| B.图2表示C12通入H2S溶液中pH的变化 |
C.图3表示10mL0.01mol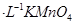 酸性溶液氧化0.1mol 酸性溶液氧化0.1mol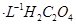 溶液时, 溶液时,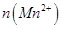 随时间的变化(M 随时间的变化(M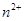 对该反应有催化作用) 对该反应有催化作用) |
D.图4表示已达平衡某反应,在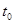 时改变某一条件后反应速率随时间变化,则改变的条件一定是加入催化剂 时改变某一条件后反应速率随时间变化,则改变的条件一定是加入催化剂 |