��Ŀ����
����Ŀ��˫��ˮ��һ����Ҫ����������Ư����������������NCP��������з�����Ҫ���á�
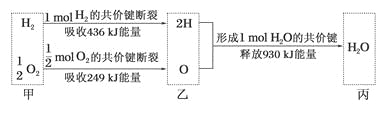
��1����ҵ����˫��ˮ�����ô������һ����������䷴Ӧ������ͼ��ʾ��

д����ҵ�Ʊ�H2O2(1)��Ӧ���Ȼ�ѧ����ʽ___��
��2�������������ͨ�����-ˮ�ⷨ�Ƶá���ҵ����Pt���缫���ϣ����������隣�����Һ�õ����������[(NH4)2S2O8]��Ȼ���������������ˮ���������識��õ��������⡣д�������ĵ缫��Ӧʽ___���������̵��ܻ�ѧ����ʽ��___��
��3��ij��������298Kʱ�о�H2O2+2HI=2H2O+I2��Ӧ���ʵ�Ӱ�����أ�ʵ�������±���
������ | 1 | 2 | 3 | 4 | 5 |
c(HI)/mol��L-1 | 0.100 | 0.200 | 0.300 | 0.100 | 0.100 |
c(H2O2)/mol��L-1 | 0.100 | 0.100 | 0.100 | 0.200 | 0.300 |
v/mol��L-1��s-1 | 0.00760 | 0.0153 | 0.0227 | 0.0151 | 0.0228 |
�����������ݣ�д����Ӧ����������Ũ�ȵĹ�ϵʽ___���÷�Ӧ�����ʳ���(k)��ֵΪ___��
��4������������ǿ�������������෴Ӧ������Ҫ��Ӧ�á���һ���¶��£���0.4molN2H4(g)��0.6molH2O2(g)װ��2L�̶��ݻ��������У�������ӦN2H4(g)+2H2O2(g)![]() N2(g)+4H2O(g) ��H<0����N2H4(g)��ת����Ϊ50%ʱ��Ӧ�ﵽƽ�⣬�÷�Ӧ�Ļ�ѧƽ�ⳣ����ֵΪ___��
N2(g)+4H2O(g) ��H<0����N2H4(g)��ת����Ϊ50%ʱ��Ӧ�ﵽƽ�⣬�÷�Ӧ�Ļ�ѧƽ�ⳣ����ֵΪ___��
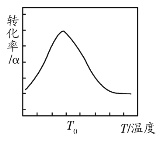
ʵ���÷�Ӧ��N2H4(g)��ת����(��)���¶�(T)�Ĺ�ϵ��ͼ��ʾ������˵���¶ȸ���T0ʱ��N2H4(g)��ת�����½���ԭ����___��
���𰸡�H2(g)+O2(g)=H2O2(1) ��H=(a+b)kJ��mol-1 2SO42--2e-=S2O82-��2HSO4--2e-=S2O82-+2H+ 2H2O![]() H2O2+H2�� v=kc(H2O2)c(HI) 0.76 2.56 �¶ȸ���T0����ѧƽ�������ƶ����¶ȸߣ���������ֽ⣬Ũ�Ƚ��ͣ�ƽ�������ƶ�
H2O2+H2�� v=kc(H2O2)c(HI) 0.76 2.56 �¶ȸ���T0����ѧƽ�������ƶ����¶ȸߣ���������ֽ⣬Ũ�Ƚ��ͣ�ƽ�������ƶ�
��������
(1)��ͼ��֪i��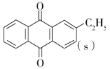 +H2(g)=
+H2(g)= 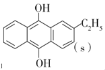 ��H=akJ��mol-1��
��H=akJ��mol-1��
ii�� + O2(g)=
+ O2(g)= + H2O2(1) ��H=bkJ��mol-1��
+ H2O2(1) ��H=bkJ��mol-1��
���ݸ�˹����i+ii�ɵ�H2(g)+O2(g)=H2O2(1) ��H=(a+b)kJ��mol-1��
(2)����������ʧ���ӷ���������Ӧ����������������隣�����Һ�õ����������[(NH4)2S2O8]���ù�����������еIJ�����ԭ����-2�۱�����Ϊ-1�ۣ����������ķ�ӦΪ��2SO42--2e-=S2O82-����������������ˮ���������識��õ��������⣬���ӷ���ʽӦΪ��S2O82-+2H2O= H2O2+2SO42-+2H+���ݴ˿�֪����������ʵ�ʾ��ǵ��ˮ������ʽΪ��2H2O![]() H2O2+H2����
H2O2+H2����
(3)Ũ��Խ��Ӧ����Խ���߳����ȣ��Ա�1��3�����ݿ�֪������Ӧ������Ũ��֮��Ϊ���ȹ�ϵ����3��ķ�Ӧ����ӦΪ1���2������ʵ�ʲ��ǣ���˷�Ӧ����Ӧ��Ũ��֮���йأ�������v=kcx(H2O2)cy(HI)������2��4�����ݿ�֪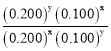 =1����x=y������0.0153=k��0.200x��0.100x��0.0076=k��0.100x��0.100x���������Խ��x=1��k=0.76�����ԣ���Ӧ����������Ũ�ȵĹ�ϵʽΪv=kc(H2O2)c(HI)������k=0.76��
=1����x=y������0.0153=k��0.200x��0.100x��0.0076=k��0.100x��0.100x���������Խ��x=1��k=0.76�����ԣ���Ӧ����������Ũ�ȵĹ�ϵʽΪv=kc(H2O2)c(HI)������k=0.76��
(4)�������ݻ�Ϊ2L�����ʼͶ��Ϊc(N2H4)=0.2mol/L��c(H2O2)=0.3mol/L��N2H4��ƽ��ת����Ϊ50%���ݴ˿ɵ�����ʽ��
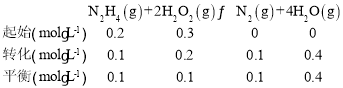
��ƽ�ⳣ��K=![]() ��
��
�÷�ӦΪ���ȷ�Ӧ���¶ȸ���T0����ѧƽ�������ƶ���ͬʱ�¶ȹ��ߣ���������ֽ⣬Ũ�Ƚ��ͣ�ƽ�������ƶ�������N2H4(g)��ת�����½���

 ��У����ϵ�д�
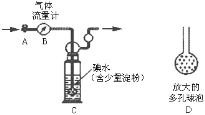
��У����ϵ�д�����Ŀ���ʰ�������[(H2NCH2COO)2Fe]��һ�����Ͳ�������ij��ѧѧϰС������ͼ��ʾװ��(�г�����ʡ��)�Ʊ��ʰ���������
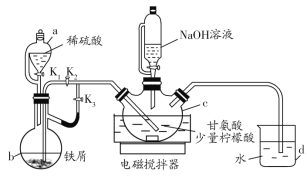
�й������������±���ʾ��
�ʰ���(H2NCH2COOH) | ������ˮ�������Ҵ��������ᣬ�ڱ��������ܽ�ȴ������Ҵ��е��ܽ�ȡ� |
������ | ������ˮ���Ҵ������Խ�ǿ����ǿ��ԭ�ԡ� |
�ʰ������� | ������ˮ���������Ҵ��������ᡣ |
ʵ�鲽�����£�
��.��K1��K3����c��ͨ�����壬��ȷ��c�п������ž���b����Һ���뵽c�С�
��.��50������������ô������������Ͻ��裬Ȼ����c�еμ�NaOH��Һ������ҺpH��5.5���ң�ʹ��Ӧ���ַ�Ӧ��
��.��Ӧ��ɺ���c�з�Ӧ���Һ�м�����ˮ�Ҵ������ɰ�ɫ���������������ˡ�ϴ�ӵôֲ�Ʒ�����ֲ�Ʒ������þ�Ʒ��
�ش��������⣺
��1������b��������__��d��������__��
��2��������н�b����Һ���뵽c�еIJ�����__�����������������ҺpHƫ�ߣ������ôֲ�Ʒ�л��������___(д��ѧʽ)��
��3��c�����ɸʰ��������Ļ�ѧ����ʽ��__��
��4�����й��ڸ�ʵ���˵���������__(��д���)��
a.������п���d�е���ð�����ݵĿ������ж�װ���еĿ����Ƿ��ž�
b.��Ӧ���Һ�м���������������Ƿ�ֹFe2+������
c.������м�����ˮ�Ҵ��������ǽ��ʰ����������ܽ��
d.������г���ϴ��ʱ��������ˮ��ϴ�Ӽ�
��5����ҵ�ϳ��ø������ڷ�ˮ��ϵ�еζ��ʰ���ķ����ⶨ��Ʒ�еĸʰ���ĺ����������ʵ�飬�����ôֲ�Ʒ�еĸʰ���������ֱ�����ڵζ���___��