题目内容
【题目】某化学兴趣小组对碳、氮、磷等常见元素的化合物性质进行如下研究.请按要求回答问题.
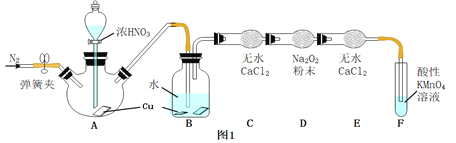
![]() 甲同学用图l所示装置
甲同学用图l所示装置![]() 部分夹持装置略
部分夹持装置略![]() 探究NO与
探究NO与![]() 的反应.
的反应.
查阅资料:
![]()
![]()
酸性条件下,NO或![]() 都能与
都能与![]() 反应生成
反应生成![]() 和
和![]()
![]() 中反应的化学方程式是 ______
中反应的化学方程式是 ______ ![]() 中观察到的主要现象是 ______ ,F装置的作用是 ______ .
中观察到的主要现象是 ______ ,F装置的作用是 ______ .
![]() 在反应前,打开弹簧夹,通入一段时间
在反应前,打开弹簧夹,通入一段时间![]() ,目的是 ______ .
,目的是 ______ .
![]() 充分反应后,检验D装置中发生反应的实验是 ______ .
充分反应后,检验D装置中发生反应的实验是 ______ .
![]() 乙同学查阅有关弱酸的电离平衡常数:
乙同学查阅有关弱酸的电离平衡常数:
化学式 |
| HCN |
|
电离平衡常数 |
|
|
|
则该温度下相同pH的![]() 、
、![]() 、
、![]() 、
、![]() 溶液的物质的量浓度由大到小的顺序为 ______
溶液的物质的量浓度由大到小的顺序为 ______ ![]() 填编号
填编号![]() .
.
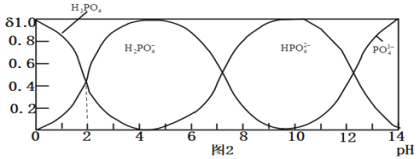
![]() 磷酸
磷酸![]() 为一种三元酸,其在水溶液中各种存在形式物质的量分数
为一种三元酸,其在水溶液中各种存在形式物质的量分数![]() 随pH的变化曲线如图2:
随pH的变化曲线如图2:
![]() 溶液中,
溶液中,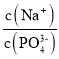 ______
______ ![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 向
向![]() 溶液中滴入稀盐酸后,pH从10降低到5的过程中发生的主要反应的离子方程式为 ______ .
溶液中滴入稀盐酸后,pH从10降低到5的过程中发生的主要反应的离子方程式为 ______ .
![]() 由图推断
由图推断![]() 溶液中各种微粒浓度关系是 ______
溶液中各种微粒浓度关系是 ______ ![]() 填选项字母
填选项字母![]()
A.![]()
B.![]()
C.![]()
D.![]()
![]() 假设在
假设在![]() 时测得
时测得![]() 溶液的
溶液的![]() ,近似计算出
,近似计算出![]() 第一步水解的水解常数
第一步水解的水解常数![]() 用
用![]() 表示
表示![]()
![]() ______
______ ![]() 忽略
忽略![]() 第二、第三步水解,结果保留两位有效数字
第二、第三步水解,结果保留两位有效数字![]() .
.
【答案】![]() 浓
浓![]() 铜片逐渐溶解,溶液变为蓝色,有无色气泡产生 吸收未反应的NO 将装置中的空气排净 取D装置中的产物少许于试管中,加稀硫酸,若产生无色气体,遇到空气变为红棕色,则产物为亚硝酸钠
铜片逐渐溶解,溶液变为蓝色,有无色气泡产生 吸收未反应的NO 将装置中的空气排净 取D装置中的产物少许于试管中,加稀硫酸,若产生无色气体,遇到空气变为红棕色,则产物为亚硝酸钠 ![]()
![]()
![]() AD
AD ![]()
【解析】
(1)![]() A中为铜与浓硝酸的反应;B二氧化氮与水反应生成硝酸,Cu与稀硝酸反应生成硝酸铜、NO和水,尾气中含有NO需要处理;
A中为铜与浓硝酸的反应;B二氧化氮与水反应生成硝酸,Cu与稀硝酸反应生成硝酸铜、NO和水,尾气中含有NO需要处理;
![]() 装置若有空气,会与NO反应;
装置若有空气,会与NO反应;
![]() 根据资料可知产物为亚硝酸钠,亚硝酸钠可以与硫酸反应生成一氧化氮。
根据资料可知产物为亚硝酸钠,亚硝酸钠可以与硫酸反应生成一氧化氮。
(2)弱电解质电离程度越强水解程度越弱;
(3)![]() 磷酸钠中钠离子不水解、磷酸根离子水解;pH从10降低到5的过程中
磷酸钠中钠离子不水解、磷酸根离子水解;pH从10降低到5的过程中![]() 浓度减小、
浓度减小、![]() 浓度增大;
浓度增大;
![]()
![]() 溶液中存在
溶液中存在![]() 的电离和水解;运用电解质溶液中电荷守恒、物料守恒以及质子守恒进行解答;
的电离和水解;运用电解质溶液中电荷守恒、物料守恒以及质子守恒进行解答;
![]()
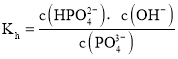 ;
;
![]() 与浓硝酸反应生成硝酸铜、二氧化氮和水,其反应的方程式为:
与浓硝酸反应生成硝酸铜、二氧化氮和水,其反应的方程式为:![]() 浓
浓![]() ;B中二氧化氮与水反应生成硝酸,Cu与稀硝酸反应生成硝酸铜、NO和水,所以溶液变蓝色,同时生成无色气体;NO能与
;B中二氧化氮与水反应生成硝酸,Cu与稀硝酸反应生成硝酸铜、NO和水,所以溶液变蓝色,同时生成无色气体;NO能与![]() 反应生成
反应生成![]() 和
和![]() ,则F装置的作用是吸收未反应的NO;
,则F装置的作用是吸收未反应的NO;
故答案为:![]() 浓
浓![]() ;铜片逐渐溶解,溶液变为蓝色,有无色气泡产生;吸收未反应的NO;
;铜片逐渐溶解,溶液变为蓝色,有无色气泡产生;吸收未反应的NO;
![]() 装置中空气能与NO反应,实验前要排尽,通入氮气能起到该作用,即将装置中的空气排净;
装置中空气能与NO反应,实验前要排尽,通入氮气能起到该作用,即将装置中的空气排净;
故答案为:将装置中的空气排净;
![]() 根据题中信息可知,D装置中产物为
根据题中信息可知,D装置中产物为![]() ,
,![]() 与硫酸反应会生成NO,要检验
与硫酸反应会生成NO,要检验![]() ,先取D装置中的产物少许于试管中,然后加稀硫酸,若产生无色气体,遇到空气变为红棕色,则产物为亚硝酸钠;
,先取D装置中的产物少许于试管中,然后加稀硫酸,若产生无色气体,遇到空气变为红棕色,则产物为亚硝酸钠;
故答案为:取D装置中是产物少许于试管中,加稀硫酸,若产生无色气体,遇到空气变为红棕色,则产物为亚硝酸钠;
![]() 弱酸的电离平衡常数越大,酸性越强,反之酸性越弱,酸性越弱,对应钠盐中酸根离子水解程度越大,pH相同时,盐的水解程度越大,其浓度越小,则浓度:
弱酸的电离平衡常数越大,酸性越强,反之酸性越弱,酸性越弱,对应钠盐中酸根离子水解程度越大,pH相同时,盐的水解程度越大,其浓度越小,则浓度:![]() ,则
,则![]() ;
;
故答案为:![]() ;
;
![]() 磷酸钠中钠离子不水解、磷酸根离子水解,所以
磷酸钠中钠离子不水解、磷酸根离子水解,所以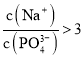 ;向
;向![]() 溶液中滴入稀盐酸后,pH从10降低到5的过程中
溶液中滴入稀盐酸后,pH从10降低到5的过程中![]() 浓度减小、
浓度减小、![]() 浓度增大,所以发生的反应为
浓度增大,所以发生的反应为![]() ,
,
故答案为:![]() ;
;![]() ;
;
![]() 、钠离子不水解,浓度最大,
、钠离子不水解,浓度最大,![]() 电离程度大于水解程度,溶液呈酸性,电离程度和水解程度都较小,所以溶液中存在
电离程度大于水解程度,溶液呈酸性,电离程度和水解程度都较小,所以溶液中存在![]() ,故A正确;
,故A正确;
B、![]() 电离程度大于水解程度,所以
电离程度大于水解程度,所以![]() ,故B错误;
,故B错误;
C、溶液中存在电荷守恒![]() ,故C错误;
,故C错误;
D、溶液中存在物料守恒![]() ,故D正确;
,故D正确;
故选AD;
③PO43-水解:PO43-+H2OHPO42—+OH—,c(HPO42—)约等于c(OH—),![]() 溶液的
溶液的![]() ,所以c(OH—)=0.01mol/L,水解的c(PO43—)= c(OH—)=0.01mol/L,所以溶液中的c(PO43—)=0.1mol/L-0.01mol/L=0.09mol/L,所以
,所以c(OH—)=0.01mol/L,水解的c(PO43—)= c(OH—)=0.01mol/L,所以溶液中的c(PO43—)=0.1mol/L-0.01mol/L=0.09mol/L,所以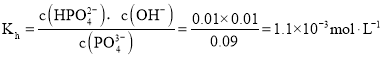 ,
,
故答案为:![]() .
.

 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案【题目】如图所示,x、y分别是直流电源的两极,通电后发现a极极板处有无色、无味的气体放出,b极极板质量增加,符合这一情况的是( )
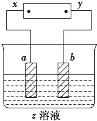
选项 | a极板 | b极板 | x电极 | z溶液 |
A | 锌 | 石墨 | 正极 | CuSO4 |
B | 石墨 | 石墨 | 负极 | NaOH |
C | 石墨 | 银 | 正极 | AgNO3 |
D | 铜 | 石墨 | 负极 | CuCl2 |
A.AB.BC.CD.D