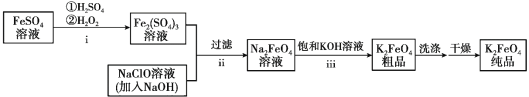
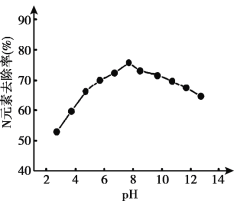
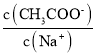题目内容
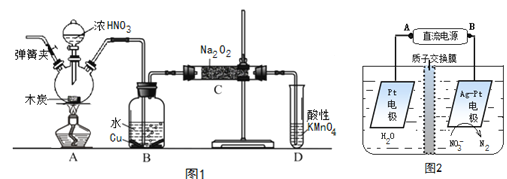
【题目】研究小组采用电解法(惰性电极)将含有Al(OH)3、MnO2和少量Na2CrO4的浆液分离成固体混合物和含铬元素的溶液,装置如下。
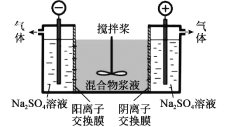
下列说法不正确的是( )
A.阳极的电极反应式为:2H2O - 4e- = O2↑+4H+
B.CrO42-通过阴离子交换膜进入阳极室,从而实现与浆液的分离
C.阴极室生成的物质可用于固体混合物Al(OH)3和MnO2的分离
D.适当增大电压,CrO42-也可在阴极室转化为Cr(OH)3除去
【答案】D
【解析】
电解时,CrO42通过阴离子交换膜向阳极移动,在阳极氢氧根离子失电子发生氧化反应,OH放电后,阳极池酸度增强,发生反应2CrO42+2H+=Cr2O72+H2O,阴极发生还原反应生成氢气和NaOH,以此解答该题。
A.阳极发生氧化反应,该电极的电极反应式为:2H2O - 4e- = O2↑+4H+,故A正确;
B.电解时,CrO42-通过阴离子交换膜向阳极移动,通电后CrO42-将通过阴离子膜进入阳极室,从而实现与浆液的分离,故B正确;
C. 阴极发生还原反应生成氢气,同时还会得到硫酸钠、氢氧化钠, Al(OH)3和MnO2中的氢氧化铝可以溶于氢氧化钠,氢氧化钠可用于固体混合物Al(OH)3和MnO2的分离,故C正确;
D. 适当增大电压,电解时,右池为阳极,阴离子向阳极移动,CrO42通过阴离子交换膜向阳极移动,从而CrO42-能从浆液中分离出,故D错误;
答案选D。

 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案【题目】某化学兴趣小组对碳、氮、磷等常见元素的化合物性质进行如下研究.请按要求回答问题.
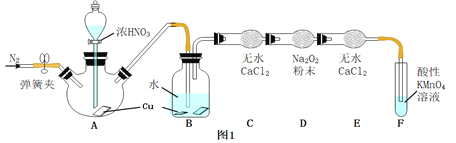
![]() 甲同学用图l所示装置
甲同学用图l所示装置![]() 部分夹持装置略
部分夹持装置略![]() 探究NO与
探究NO与![]() 的反应.
的反应.
查阅资料:
![]()
![]()
酸性条件下,NO或![]() 都能与
都能与![]() 反应生成
反应生成![]() 和
和![]()
![]() 中反应的化学方程式是 ______
中反应的化学方程式是 ______ ![]() 中观察到的主要现象是 ______ ,F装置的作用是 ______ .
中观察到的主要现象是 ______ ,F装置的作用是 ______ .
![]() 在反应前,打开弹簧夹,通入一段时间
在反应前,打开弹簧夹,通入一段时间![]() ,目的是 ______ .
,目的是 ______ .
![]() 充分反应后,检验D装置中发生反应的实验是 ______ .
充分反应后,检验D装置中发生反应的实验是 ______ .
![]() 乙同学查阅有关弱酸的电离平衡常数:
乙同学查阅有关弱酸的电离平衡常数:
化学式 |
| HCN |
|
电离平衡常数 |
|
|
|
则该温度下相同pH的![]() 、
、![]() 、
、![]() 、
、![]() 溶液的物质的量浓度由大到小的顺序为 ______
溶液的物质的量浓度由大到小的顺序为 ______ ![]() 填编号
填编号![]() .
.
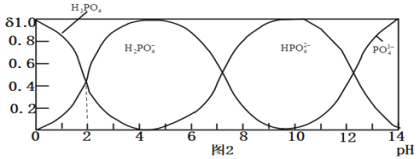
![]() 磷酸
磷酸![]() 为一种三元酸,其在水溶液中各种存在形式物质的量分数
为一种三元酸,其在水溶液中各种存在形式物质的量分数![]() 随pH的变化曲线如图2:
随pH的变化曲线如图2:
![]() 溶液中,
溶液中,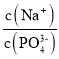 ______
______ ![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 向
向![]() 溶液中滴入稀盐酸后,pH从10降低到5的过程中发生的主要反应的离子方程式为 ______ .
溶液中滴入稀盐酸后,pH从10降低到5的过程中发生的主要反应的离子方程式为 ______ .
![]() 由图推断
由图推断![]() 溶液中各种微粒浓度关系是 ______
溶液中各种微粒浓度关系是 ______ ![]() 填选项字母
填选项字母![]()
A.![]()
B.![]()
C.![]()
D.![]()
![]() 假设在
假设在![]() 时测得
时测得![]() 溶液的
溶液的![]() ,近似计算出
,近似计算出![]() 第一步水解的水解常数
第一步水解的水解常数![]() 用
用![]() 表示
表示![]()
![]() ______
______ ![]() 忽略
忽略![]() 第二、第三步水解,结果保留两位有效数字
第二、第三步水解,结果保留两位有效数字![]() .
.