题目内容
3.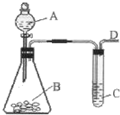 某同学用如图所示装置探究SO2的性质及其有关实验.
某同学用如图所示装置探究SO2的性质及其有关实验.(1)实验室用亚硫酸钠固体和一定浓度的硫酸反应制备SO2气体,写出该反应的化学方程式Na2SO3+H2SO4═Na2SO4+SO2↑+H2O
(2)分别将SO2气体通人下列c溶液中,请回答下列问题:
①少量SO2通入紫色石蕊试液,现象是溶液变红,继续通入过量SO2气体,现象是红色不褪去.
②SO2通入紫红色KMnO4溶液,现象是褪色,
③少量SO2慢慢地通入澄清石灰水中,现象变浑浊.
④SO2慢慢地通入品红溶液中,现象是品红褪色,若该同学制备的SO2气体中混有CO2气体,产生杂质的原因可能是亚硫酸钠固体中混有碳酸盐.
分析 (1)亚硫酸钠与硫酸反应生成二氧化硫、硫酸钠和水;
(2)①二氧化硫为酸性氧化物与水反应生成亚硫酸;
②依据二氧化硫的还原性解答;
③二氧化硫与氢氧化钙反应生成亚硫酸钙沉淀;
④依据二氧化硫具有漂白性结合碳酸盐与盐酸反应生成二氧化碳解答.
解答 解:(1)亚硫酸钠与硫酸反应生成二氧化硫、硫酸钠和水,化学方程式:Na2SO3+H2SO4═Na2SO4+SO2↑+H2O;
故答案为:Na2SO3+H2SO4═Na2SO4+SO2↑+H2O;
(2)①二氧化硫为酸性氧化物与水反应生成亚硫酸,亚硫酸电离产生氢离子,溶液显酸性,少量SO2通入紫色石蕊试液溶液变红,二氧化硫不能漂白石蕊试液,所以红色不退去;
故答案为:溶液变红;红色不褪去;
②二氧化硫具有强的还原性,能够还原酸性的高锰酸钾,使其褪色,
故答案为:褪色;
③二氧化硫与氢氧化钙反应生成亚硫酸钙沉淀,所以看到现象为:溶液变浑浊;
故答案为:变浑浊;
④二氧化硫具有漂白性,能够使品红溶液褪色;制备二氧化硫用的亚硫酸钠中若含有碳酸钠等,碳酸盐能够与盐酸反应生成二氧化碳,
故答案为:品红褪色;碳酸盐.
点评 本题考查了元素化合物知识,明确二氧化硫的漂白性、酸性氧化物性质、还原性是解题关键,注意二氧化硫漂白的原理,题目难度不大.

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
2.下列各组离子在溶液中既可以大量共存,且加入氢氧化钠溶液后也不产生沉淀的是( )
| A. | Na+ Ba2+ Cl- SO42- | B. | K+ Na+ NO3- OH- | ||
| C. | H+ NH4+ Fe3+ SO42- | D. | H+ Cl- CO32- NO3- |
14.下列说法正确的是( )
| A. | 1 mol苯甲酸在浓H2SO4存在下与足量乙醇反应可得1 mol苯甲酸乙酯 | |
| B. | 分子式为C4H8Cl2结构中含一个-CH3的同分异构体(不考虑立体异构)有5种 | |
| C. | 1mol乙酰水杨酸( )最多可以和2molNaOH反应 )最多可以和2molNaOH反应 | |
| D. | 可用 和HCHO为原料合成 和HCHO为原料合成 |
18.在一定温度下,一定量的水中,Mg(OH)2悬浊液里有如下平衡:Mg(OH)2(s)?Mg2+(aq)+2OH-(aq),当向混合物中加入少量粉末状MgO时,下列说法正确的是( )
| A. | Mg2+的数目减少 | B. | Mg2+的浓度增大 | ||
| C. | 溶液pH不变 | D. | Mg(OH)2固体质量不变 |
8.关于化学能与热能的叙述,正确的是( )
| A. | 1mol酸与碱恰好中和时所放出的热量叫中和热 | |
| B. | 化学反应中的能量变化,主要是由化学键的变化引起的 | |
| C. | 燃料电池反应时,化学能升高 | |
| D. | 反应物的总能量高于生成物总能量的反应,不需要加热就可自行反应 |
15.下列事实中,能够证明化合物NaCl是离子化合物的是( )
| A. | NaCl易溶于水 | B. | 熔融的NaCl能导电 | ||
| C. | NaCl不易分解 | D. | NaCl溶于水呈中性 |
12.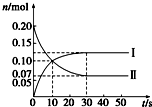 (1)在容积为2L的密闭容器中,保持体系内温度800℃不变,将一定量的NO和O2混合发生反应:2NO+O2?2NO2,其中NO的物质的量(n)随时间(t)的变化关系如图所示,请回答下列问题.
(1)在容积为2L的密闭容器中,保持体系内温度800℃不变,将一定量的NO和O2混合发生反应:2NO+O2?2NO2,其中NO的物质的量(n)随时间(t)的变化关系如图所示,请回答下列问题.
①图象中曲线I (选填“Ⅰ”或“Ⅱ”)表示NO2的变化.
②若升高反应体系的温度,使反应重新达到平衡,此时体系中n(NO)=n(NO2),则该反应是放热反应.
③在800℃时,若缩小容器的体积,达新平衡时n(NO)< (选填“>”、“=”或“<”)0.07mol,NO的转化率增大 (选填“增大”、“不变”或“减小”)
(2)一定条件下,体积为1L的密闭容器中发生如下反应:SiF4(g)+2H2O(g)?SiO2(s)+4HF(g)△H=+148.9kJ•mol-1
①下列各项中能说明该反应已达化学平衡状态的是bcd(填字母序号)
a.v消耗(SiF4)=4v生成(HF) b.容器内气体压强不再变化
c.容器内气体的总质量不再变化 d.HF的体积分数不再变化
②反应过程中测定的部分数据如下表(表中t2>t1)所示.
通过a或b的值及化学平衡原理判断t1时反应是否达到化学平衡状态t1时反应已经达到化学平衡状态.
 (1)在容积为2L的密闭容器中,保持体系内温度800℃不变,将一定量的NO和O2混合发生反应:2NO+O2?2NO2,其中NO的物质的量(n)随时间(t)的变化关系如图所示,请回答下列问题.
(1)在容积为2L的密闭容器中,保持体系内温度800℃不变,将一定量的NO和O2混合发生反应:2NO+O2?2NO2,其中NO的物质的量(n)随时间(t)的变化关系如图所示,请回答下列问题.①图象中曲线I (选填“Ⅰ”或“Ⅱ”)表示NO2的变化.
②若升高反应体系的温度,使反应重新达到平衡,此时体系中n(NO)=n(NO2),则该反应是放热反应.
③在800℃时,若缩小容器的体积,达新平衡时n(NO)< (选填“>”、“=”或“<”)0.07mol,NO的转化率增大 (选填“增大”、“不变”或“减小”)
(2)一定条件下,体积为1L的密闭容器中发生如下反应:SiF4(g)+2H2O(g)?SiO2(s)+4HF(g)△H=+148.9kJ•mol-1
①下列各项中能说明该反应已达化学平衡状态的是bcd(填字母序号)
a.v消耗(SiF4)=4v生成(HF) b.容器内气体压强不再变化
c.容器内气体的总质量不再变化 d.HF的体积分数不再变化
②反应过程中测定的部分数据如下表(表中t2>t1)所示.
| 反应时间/min | n(SiF4)/mol | n(H2O)/mol |
| 0 | 1.20 | 2.40[ |
| t1 | 0.80 | a |
| t2 | b | 1.60 |

 如图所示的试管内,已知一层是水,另一层是有机物,下列操作肯定能确定哪一层是水层的为( )
如图所示的试管内,已知一层是水,另一层是有机物,下列操作肯定能确定哪一层是水层的为( )