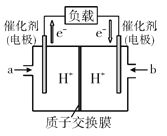
题目内容
【题目】有甲、乙两个完全相同的装置,分别在它们的侧管中装入1.06g Na2CO3和0.84g NaHCO3,试管中各有10mL相同浓度的盐酸(如图),同时将两个侧管中的物质全部倒入各自的试管中,下列叙述正确的是
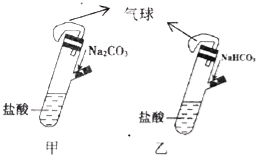
A. 甲装置的气球膨胀速率大
B. 若最终两气球体积相同,则一定有c(HCl)≥2 mol/L
C. 若最终两气球体积不同,则一定有c(HCl)≤1 mol/L
D. 最终两溶液中Na+、Cl﹣的物质的量相同
【答案】B
【解析】试题碳酸氢钠与盐酸反应放出气体的速率比碳酸钠快,故A错误;若最终两气球体积相同,说明Na2CO3和NaHCO3均完全反应,碳酸钠消耗盐酸的物质的量是0.02mol,所以c(HCl)≥2 mol L-1,故B正确;根据B可知,若最终两气球体积不同,碳酸钠消耗盐酸的物质的量小于0.02mol,则一定有 c(HCI)< 2mol L-1,故C错误;根据元素守恒,两溶液中Na+的物质的量不相同,故D错误。

练习册系列答案
相关题目