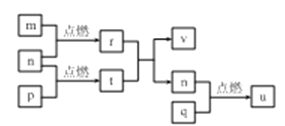
题目内容
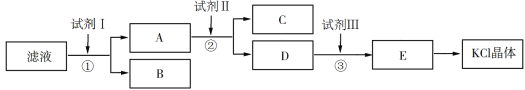
【题目】硫酸亚铁是利用钛铁矿(主要成分FeTiO3)制金属钛的副产品,价格低。以硫酸亚铁为原料制备高效净水剂高铁酸钾(K2FeO4)可大大降低成本。其生产工艺如下:
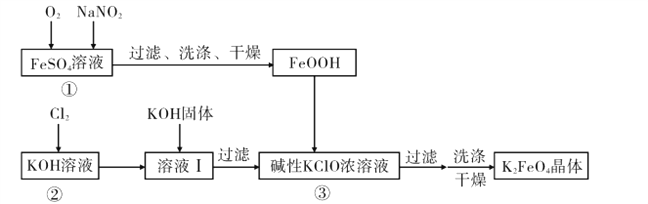
已知:NaNO2是在空气中将Fe2+氧化为铁黄(FeOOH)的催化剂;铁黄微溶于酸。
请问答下列问题:
(1)写出反应①生成铁黄(FeOOH)的离子方程式:__________________________________,
在通入O2“氧化”FeSO4的过程中,溶液的pH________(填“增大”“减小”或“不变”)
(2)“过滤、洗涤、干燥”制备铁黄时,检验铁黄表面已洗涤干净的操作是_____。
(3)写出反应③的化学方程式: ____。
(4)在溶液I中加KOH固体的目的是_____。
(5) K2FeO4可作为新型多功能水处理剂的原因是____。
(6)该工艺每消耗标准状况下ll2LCl2理论上得到____g K2FeO4。
(7)钛铁矿加入浓硫酸除生成TiOSO4外,还生成水和另外一种硫酸盐,且反应前后铁的化合价不变,化学方程式为____。
【答案】 4Fe2++O2 +6H2O ![]() 4FeOOH↓+8H+ 减小 取少量最后一次的洗涤液于试管中,滴加盐酸酸化的BaCl2溶液,若无白色沉淀生成,则说明已被洗净 2FeOOH +3KC1O+4KOH =2 K2FeO4+3H2O+3KCl 除KCl;为下一步反应提供反应物;除去过量Cl2 K2FeO4具有强氧化性,能杀菌消毒;消毒过程中白身被还原为Fe3+,Fe3+水解生成Fe(OH)3胶体能吸附水中悬浮杂质而沉降 660 FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O
4FeOOH↓+8H+ 减小 取少量最后一次的洗涤液于试管中,滴加盐酸酸化的BaCl2溶液,若无白色沉淀生成,则说明已被洗净 2FeOOH +3KC1O+4KOH =2 K2FeO4+3H2O+3KCl 除KCl;为下一步反应提供反应物;除去过量Cl2 K2FeO4具有强氧化性,能杀菌消毒;消毒过程中白身被还原为Fe3+,Fe3+水解生成Fe(OH)3胶体能吸附水中悬浮杂质而沉降 660 FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O
【解析】 (1)反应①中硫酸亚铁在亚硝酸钠存在时被氧气氧化生成铁黄(FeOOH)的离子方程式为4Fe2++O2 +6H2O ![]() 4FeOOH↓+8H+,根据方程式可知,在通入O2“氧化”FeSO4的过程中,溶液的酸性逐渐增强,pH减小,故答案为:4Fe2++O2 +6H2O
4FeOOH↓+8H+,根据方程式可知,在通入O2“氧化”FeSO4的过程中,溶液的酸性逐渐增强,pH减小,故答案为:4Fe2++O2 +6H2O ![]() 4FeOOH↓+8H+;减小;
4FeOOH↓+8H+;减小;
(2)铁黄表面附着少量硫酸钠溶液,检验铁黄表面已洗涤干净的操作为取少量最后一次的洗涤液于试管中,滴加盐酸酸化的BaCl2溶液,若无白色沉淀生成,则说明已被洗净,故答案为:取少量最后一次的洗涤液于试管中,滴加盐酸酸化的BaCl2溶液,若无白色沉淀生成,则说明已被洗净;
(3)根据流程图,反应③中铁黄与碱性次氯酸钾溶液反应生成K2FeO4,反应的化学方程式为,故答案为:2FeOOH +3KC1O+4KOH =2 K2FeO4+3H2O+3KCl;
(4)在溶液I中加KOH固体可以除去过量Cl2,也可以为下一步反应提供反应物,故答案为:除KCl;为下一步反应提供反应物;除去过量Cl2等;
(5) K2FeO4具有强氧化性,能杀菌消毒;消毒过程中白身被还原为Fe3+,Fe3+水解生成Fe(OH)3胶体能吸附水中悬浮杂质而沉降,使得K2FeO4成为新型多功能水处理剂,故答案为:K2FeO4具有强氧化性,能杀菌消毒;消毒过程中白身被还原为Fe3+,Fe3+水解生成Fe(OH)3胶体能吸附水中悬浮杂质而沉降;
(6) 标准状况下112LCl2的物质的量为5mol,氯气与氢氧化钾反应生成次氯酸钾,可以得到5molKClO,根据2FeOOH +3KC1O+4KOH =2 K2FeO4+3H2O+3KCl。可以得到5mol×![]() =
=![]() mol K2FeO4,质量为
mol K2FeO4,质量为![]() mol×198g/mol=660g,故答案为:660;
mol×198g/mol=660g,故答案为:660;
(7)钛铁矿(主要成分FeTiO3)加入浓硫酸除生成TiOSO4外,还生成水和另外一种硫酸盐,在TiOSO4中Ti的化合价为+4价,则FeTiO3中Fe的化合价为+2价,反应前后铁的化合价不变,则该硫酸盐为硫酸亚铁,反应的化学方程式为FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O,故答案为:FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O。