题目内容
【题目】物质的组成与结构决定了物质的性质与变化。请回答下列问题:
(1)C、H、N、O四种元素中电负性最大的是____(填元素符号),写出Fe2+的最外层电子排布式____。
(2)根据等电子原理,写出CN-的电子式___,CNO-中心原子的杂化方式为 ________。
(3)MgO、CaO两种晶体的结构与NaCl晶体结构相似,则两种离子晶体的熔点由高到低顺序是 ___(用化学式表示),![]() 的沸点比
的沸点比 ____(填“高”或“低”);原因是______________________.
____(填“高”或“低”);原因是______________________.
(4)铁有δ、γ、α三种同素异形体,如下图所示。

γ -Fe晶体的一个晶胞中所含有的铁原子数为____,δ一Fe、α- Fe两种晶胞中铁原子的配位数之比为____。已知δ-Fe晶体的密度为dg/cm3,NA表示阿伏伽德罗常数的数值,则Fe原子半径为____pm(列表达式)。
【答案】 O 3s23p63d6 ![]() sp MgO〉CaO 高 由于
sp MgO〉CaO 高 由于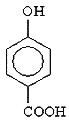 可形成分子间氢键,而
可形成分子间氢键,而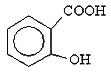 可形成分子内氢键,故
可形成分子内氢键,故 的沸点比
的沸点比 高 4 4:3
高 4 4:3 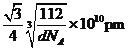
【解析】(1)同周期元素从左到右元素的电负性逐渐增大,则有电负性C<N<O,H的电负性最小,所以电负性最大的是O;基态Fe原子的核外价电子排布式为[Ar]3d64S2,则Fe2+的最外层电子排布式为3s23p63d6,故答案为:O;3s23p63d6;
(2) CN-与N2属于等电子体,则CN-的电子式为![]() ,CNO-与CO2属于等电子体,二氧化碳为直线分子,中心原子的杂化方式为sp杂化,故答案为:
,CNO-与CO2属于等电子体,二氧化碳为直线分子,中心原子的杂化方式为sp杂化,故答案为:![]() ;sp;
;sp;
(3) 离子晶体的离子半径越小,带电荷数越多,晶格能越大,则晶体的熔沸点越高,镁离子半径小于钙离子半径,则熔点MgO>CaO;由于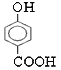 可形成分子间氢键,而
可形成分子间氢键,而![]() 可形成分子内氢键,故
可形成分子内氢键,故 的沸点比
的沸点比![]() 高,故答案为:>;高;由于
高,故答案为:>;高;由于 可形成分子间氢键,而
可形成分子间氢键,而![]() 可形成分子内氢键,故
可形成分子内氢键,故 的沸点比
的沸点比![]() 高;
高;
(4) γ晶体晶胞中所含有的铁原子数为8×![]() +6×
+6×![]() =4,δ、α两种晶胞中铁原子的配位数分别为8、6,则配位数之比为8:6=4:3,由晶胞图可知,δ型晶体铁晶胞中Fe原子数目为8×
=4,δ、α两种晶胞中铁原子的配位数分别为8、6,则配位数之比为8:6=4:3,由晶胞图可知,δ型晶体铁晶胞中Fe原子数目为8×![]() +1=2,晶胞质量为
+1=2,晶胞质量为![]() g,δ型晶体铁的密度为dg/cm3,晶胞体积为
g,δ型晶体铁的密度为dg/cm3,晶胞体积为![]() g÷dg/cm3=
g÷dg/cm3=![]() cm3,则晶胞棱长=
cm3,则晶胞棱长=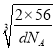 cm,处于体对角线上的原子相邻,则4r=
cm,处于体对角线上的原子相邻,则4r=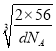 cm×
cm×![]() ,故r=
,故r=![]() ×
×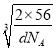 cm=
cm=![]() ×
×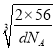 ×1010pm,故答案为:4;4:3;
×1010pm,故答案为:4;4:3; ![]() ×
×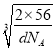 ×1010。
×1010。

 全能测控一本好卷系列答案
全能测控一本好卷系列答案
