题目内容
今有氧、镁、铝、硫、铬5种元素,试回答下列问题
(1)镁晶体堆积方式为 堆积(选填:“简单立方”、“体心立方”、“面心立方”、“六方”);
(2)用“>”、“<”填写下表
(3)基态铬原子外围电子轨道表示式为 .
(1)镁晶体堆积方式为
(2)用“>”、“<”填写下表
| 第一电离能 | 电负性 | 晶格能 | 沸点 |
| Mg | O | MgO | H2O |
考点:金属晶体,原子核外电子排布,元素电离能、电负性的含义及应用
专题:化学键与晶体结构
分析:(1)金属晶体中金属原子有三种常见的堆积方式,六方堆积(镁型)、面心立方堆积(铜型)和体心立方堆积(钾型);
(2)同周期从左到右第一电离能呈增大趋势,其中第IIA族和第IIIA族反常,第VA族和第VIA族反常;
同主族从上到下电负性逐渐减小;
离子所带电荷越多、离子半径越小,晶格能越大;
分子晶体中,物质的熔沸点与其相对分子质量成正比,但有氢键例外;
(3)根据基态铬原子外围电子排布式来书写轨道表示式;
(2)同周期从左到右第一电离能呈增大趋势,其中第IIA族和第IIIA族反常,第VA族和第VIA族反常;
同主族从上到下电负性逐渐减小;
离子所带电荷越多、离子半径越小,晶格能越大;
分子晶体中,物质的熔沸点与其相对分子质量成正比,但有氢键例外;
(3)根据基态铬原子外围电子排布式来书写轨道表示式;
解答:
解:(1)镁晶体堆积方式为六方堆积;
故答案为:六方;
(2)同周期从左到右第一电离能逐渐增大,其中第IIA族和第IIIA族反常,所以第一电离能:N>O;
同主族从上到下电负性逐渐减小,所以电负性:O>S;
MgO、MgS中离子所带电荷一样、但前者的阳离子、阴离子半径都比后者小,所以晶格能:MgO>MgS;
H2O中含有氢键,所以沸点:H2O>H2S;
故答案为:>;>;>;>;
(3)基态铬原子外围电子排布式为:3d54s1,轨道表示式为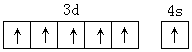 ;
;
故答案为: ;
;
故答案为:六方;
(2)同周期从左到右第一电离能逐渐增大,其中第IIA族和第IIIA族反常,所以第一电离能:N>O;
同主族从上到下电负性逐渐减小,所以电负性:O>S;
MgO、MgS中离子所带电荷一样、但前者的阳离子、阴离子半径都比后者小,所以晶格能:MgO>MgS;
H2O中含有氢键,所以沸点:H2O>H2S;
故答案为:>;>;>;>;
(3)基态铬原子外围电子排布式为:3d54s1,轨道表示式为
 ;
;故答案为:
 ;
;
点评:本题考查物质结构和性质,涉及原子核外电子排布、元素周期律等知识点,这些是学习难点,也是考查重点,同时考查学生空间想象能力,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列数据是对应物质的熔点,有关的判断错误的是( )
| Na2O | Na | AlF3 | AlCl3 | Al2O3 | BCl3 | CO2 | SiO2 |
| 920℃ | 97.8℃ | 1291℃ | 190℃ | 2073℃ | -107℃ | -57℃ | 1723℃ |
| A、含有金属阳离子的晶体不一定是离子晶体 |
| B、在共价化合物分子中各原子都形成8电子结构 |
| C、同族元素的氧化物可形成不同类型的晶体 |
| D、金属晶体的熔点不一定比分子晶体的高 |
在乙醇发生的各种反应中,断键方式不正确的是( )
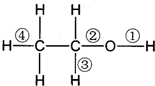

| A、与金属钠反应时,键①断裂 |
| B、与醋酸、浓硫酸共热时,键②断裂 |
| C、与浓硫酸共热至170℃时,键②和④断裂 |
| D、与HCl反应生成氯乙烷时,键②断裂 |
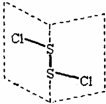 二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示,遇水易水解,并产生能使品红褪色的气体.S2Br2与S2Cl2结构相似.下列说法错误的是( )
二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示,遇水易水解,并产生能使品红褪色的气体.S2Br2与S2Cl2结构相似.下列说法错误的是( )| A、S2Cl2中硫原子轨道杂化类型为sp3杂化 |
| B、S2Cl2为含有极性键和非极性键的非极性分子 |
| C、熔沸点:S2Br2>S2Cl2 |
| D、S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O═SO2↑+3S↓+4HCl |
下列各组物质中,互为同分异构体的是( )
| A、O2与O3 | ||||
B、
| ||||
| C、CH2Cl2与CHCl3 | ||||
D、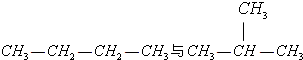 |