题目内容
TiO2在工业生产和日常生活中有重要用途。
(1)工业上用钛矿石(FeTiO3,含FeO、Al2O3、SiO2等杂质)经过下述反应制得: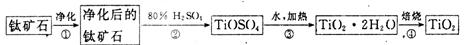
其中,步骤②发生的主要反应为:2H2SO4+FeTiO3 ="=" TOSO4(硫酸氧钛)+FeSO4+2H2O
净化钛矿石时,需用浓氢氧化钠溶液来处理。写出该过程中发生反应的化学方程式:________________。
步骤③中加热的目的是(请写出必要的化学方程式和文字): 。
(2)用TiO2制备金属钛的一种方法是先将TiO2与Cl2、C反应得到TiCl4,再用镁还原得到Ti。因下述反应难于发生:TiO2(s)+2Cl2(g)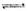 TiCl4(1)+O2(g) △H=+151 kJ/mol。所以不能直接由TiO2和Cl2反应(即氯化反应)来制取TiCl4,请说明判断该反应难以发生的理由是_______。当往氯化反应体系中加入碳后,反应在高温条件下能顺利进行生成TiCl4。
TiCl4(1)+O2(g) △H=+151 kJ/mol。所以不能直接由TiO2和Cl2反应(即氯化反应)来制取TiCl4,请说明判断该反应难以发生的理由是_______。当往氯化反应体系中加入碳后,反应在高温条件下能顺利进行生成TiCl4。
已知:C(s)+O2(g)=CO2(g) △H=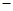 394 kJ/mol。
394 kJ/mol。
则TiO2(s)+C(s)+2Cl2(g)=TiCl4(1)+CO2(g) △H=________
从化学平衡的角度解释:往氯化反应体系中加入碳时,氯化反应能顺利进行的原因是_______________。
(3)下图是一种染料敏化太阳能电池的示意图。电池的一个由有机光敏染料(S)涂覆TiO2纳米晶体表面制成,另一电极由导电玻璃镀铂构成,电池中发生的反应为:
TiO2/S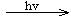 TiO2/S*(激发态)
TiO2/S*(激发态)
TiO2/S*  TiO2/S+ + e-
TiO2/S+ + e-
I3-+2e- 3I-
3I-
2TiO2/S*+I3-  2TiO2/S + I3-
2TiO2/S + I3-
下列关于该电池叙述正确的是
| A.电池工作时,I-离子在镀铂导电玻璃电极上放电 |
| B.电池工作时,是将太阳能转化为电能 |
| C.电池的电解质溶液中I-和I3- 浓度不会减少 |
| D.电池中镀铂导电玻璃为正极 |
(共14分)(1)Al2O3 + 2NaOH=2NaAlO2 + H2O (2分) SiO2 + 2NaOH=Na2SiO3 + H2O(2分)
TiOSO4的水解TiOSO4 + 2H2O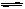 H2TiO3↓+ H2SO4是一个吸热反应,加热促进TiOSO4水解趋于完全。(2分) (2)该反应的△H>0,△S<0,反应难以自发进行(2分);-243kJ/mol(2分);TiO2(s)+2Cl2(g)
H2TiO3↓+ H2SO4是一个吸热反应,加热促进TiOSO4水解趋于完全。(2分) (2)该反应的△H>0,△S<0,反应难以自发进行(2分);-243kJ/mol(2分);TiO2(s)+2Cl2(g) TiCl4(1)+O2(g) 碳与氧气反应,减小了产物O2(g)的浓度,平衡向正反应方向移动,使反应能顺利进行(1分) (3)BCD(3分)
TiCl4(1)+O2(g) 碳与氧气反应,减小了产物O2(g)的浓度,平衡向正反应方向移动,使反应能顺利进行(1分) (3)BCD(3分)
解析试题分析:(1)由于钛矿石中含有氧化铝和二氧化硅,氧化铝是两性氢氧化物,二氧化硅是酸性氧化物,它们均能和氢氧化钠溶液反应,所以该过程中发生反应的化学方程式是Al2O3 + 2NaOH=2NaAlO2 + H2O、SiO2 + 2NaOH=Na2SiO3 + H2O。步骤③是TiOSO4的水解生成钛酸的过程,由于TiOSO4的水解TiOSO4 + 2H2O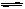 H2TiO3↓+ H2SO4是一个吸热反应,因此加热的目的是促进TiOSO4水解趋于完全。(2)根据反应的方程式可知,该反应是吸热的、体积减小的可逆反应,即该反应的△H>0,△S<0, 所以反应难以自发进行;根据反应①TiO2(s)+2Cl2(g)
H2TiO3↓+ H2SO4是一个吸热反应,因此加热的目的是促进TiOSO4水解趋于完全。(2)根据反应的方程式可知,该反应是吸热的、体积减小的可逆反应,即该反应的△H>0,△S<0, 所以反应难以自发进行;根据反应①TiO2(s)+2Cl2(g) TiCl4(1)+O2(g)和反应②C(s)+O2(g)=CO2(g)并结合盖斯定律可,①+②即得到TiO2(s)+C(s)+2Cl2(g)=TiCl4(1)+CO2(g) ,所以该反应的反应热△H=+151 kJ/mol-394 kJ/mol=-243kJ/mol。由于碳与氧气反应,减小了产物O2(g)的浓度,使可逆反应TiO2(s)+2Cl2(g)
TiCl4(1)+O2(g)和反应②C(s)+O2(g)=CO2(g)并结合盖斯定律可,①+②即得到TiO2(s)+C(s)+2Cl2(g)=TiCl4(1)+CO2(g) ,所以该反应的反应热△H=+151 kJ/mol-394 kJ/mol=-243kJ/mol。由于碳与氧气反应,减小了产物O2(g)的浓度,使可逆反应TiO2(s)+2Cl2(g) TiCl4(1)+O2(g)向正反应方向移动,所以能使反应能顺利进行。
TiCl4(1)+O2(g)向正反应方向移动,所以能使反应能顺利进行。
(3)根据图中电子的移动方向可知,在外电路中电子由负极流向正极,即半导材料TiO2与染料为原电池的负极,铂电极为原电池的正极,电解质为I3-和I-的混合物,I3-在正极上得电子被还原,正极反应为I3-+2e-=3I-。则
A、电池工作时,I=离子在铂电极上放电,发生氧化反应,A不正确;
B. 该电池是将太阳能转化为电能的装置,故B正确;
C. 将已知的4个反应合并即得到总反应I3- 3I-,所以电池的电解质溶液中I-和I3- 浓度不会减少,C正确;
3I-,所以电池的电解质溶液中I-和I3- 浓度不会减少,C正确;
D.电池中镀铂导电玻璃为正极,D正确,答案选BCD。
考点:考查物质的分离与提纯;外界条件对平衡状态的影响;反应自发性的判断;电化学原理的有关应用

 习题精选系列答案
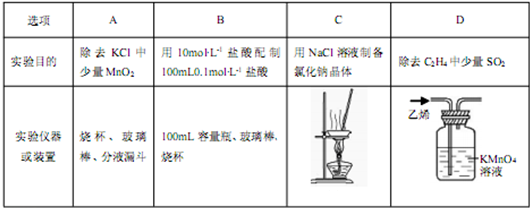
习题精选系列答案下列有关实验装置进行的相应实验,能达到实验目的的是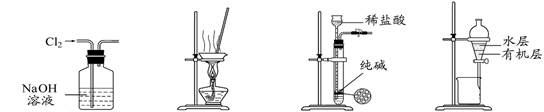
图1 图2 图3 图4
| A.用图1所示装置除去Cl2中含有的少量HCl |
| B.用图2所示装置蒸干FeCl3饱和溶液制备FeCl3晶体 |
| C.用图3所示装置制取少量纯净的CO2气体 |
| D.用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层 |
下列有关实验装置进行的相应实验,能达到实验目的的是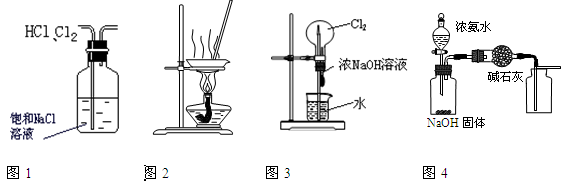
| A.用图1所示装置除去HCl中含有的少量Cl2 |
| B.用图2所示装置蒸发FeCl3溶液制备无水FeCl3 |
| C.用图3所示装置可以完成“喷泉”实验 |
| D.用图4所示装置制取并收集干燥纯净的NH3 |
某同学用下列装置制备并检验Cl2的性质。下列说法正确的是
| A.Ⅰ图中:如果MnO2过量,盐酸可全部被消耗 |
| B.Ⅱ图中:湿润的有色布条褪色,证明Cl2有漂白性 |
| C.Ⅲ图中:生成棕色的固体,证明Cl2有强氧化性 |
| D.Ⅳ图中:光照后量筒中气体体积减小,说明甲烷与Cl2发生了加成反应 |
下列物质能用于萃取溴水中的溴的是
| A.直馏汽油 | B.裂化汽油 | C.酒精 | D.己烷 |
实验室进行NaCl溶液蒸发时,一般有以下操作过程:①固定铁圈位置;②放置酒精灯;③放上蒸发皿;④加热搅拌;⑤停止加热、余热蒸干。其正确操作的顺序是( )
| A.②①③④⑤ | B.①②③④⑤ | C.②③①④⑤ | D.②③①④⑤ |
海带中含丰富的碘元素,从海带中分离出碘可按如下步骤进行:①滴加稀硫酸酸化后,加入适量H2O2(质量分数为3%) ②将海带焙烧成灰后加水搅拌 ③加CCl4振荡 ④用分液漏斗分液 ⑤煮沸、过滤。合理的操作顺序是
| A.①②③④⑤ | B.①③⑤②④ | C.②⑤①③④ | D.②①③⑤④ |