题目内容
下列有关实验装置进行的相应实验,能达到实验目的的是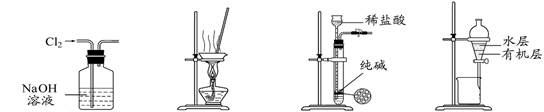
图1 图2 图3 图4
| A.用图1所示装置除去Cl2中含有的少量HCl |
| B.用图2所示装置蒸干FeCl3饱和溶液制备FeCl3晶体 |
| C.用图3所示装置制取少量纯净的CO2气体 |
| D.用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层 |
D
解析试题分析:A、NaOH能吸收Cl2,错误;B、直接加热蒸干FeCl3溶液,FeCl3发生水解反应,蒸干时生成Fe(OH)3,无法得到FeCl3晶体,错误;C、图3实验装置适用于颗粒较大的固体与液体反应,Na2CO3颗粒较小,不适合;D、用分液漏斗分离CCl4萃取碘水后已分层的有机层和水层,正确。
考点:本题考查化学实验基本操作和基本仪器的使用。

海带中含碘元素,从海带中提取碘有如下步骤:①通入足量Cl2 ②将海带焙烧成灰后加水搅拌 ③加CCl4振荡 ④用分液漏斗分液 ⑤过滤
合理的操作顺序是( )
| A.①②③④⑤ | B.②⑤①③④ | C.①③⑤②④ | D.②①③⑤④ |
从海带中提取碘的实验过程中,涉及到下列操作,其中正确的是(考查每一个操作时,假设其它操作均正确)( )
 | 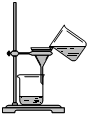 |  |  |
| A.海带灼烧成灰 B.过滤得含I-溶液 C.放出碘的苯溶液 D.分离碘并回收苯 | |||
下列实验方案设计正确的是
| A.分解高锰酸钾制氧气后,残留在试管内壁上的黑色物质可用稀盐酸洗涤 |
| B.失去标签的硝酸银溶液、稀盐酸、氢氧化钠溶液、氯化铝溶液,可以用碳酸铵溶液鉴别 |
| C.将CuCl2溶液在蒸发皿中加热蒸干,得到无水CuCl2固体 |
| D.检验从火星上带回来的红色物体是否是Fe2O3 的操作步骤为:样品→粉碎→加水溶解→过滤→向滤液中滴加KSCN溶液 |
下列鉴别方法可行的是
| A.用NH3·H2O溶液鉴别Al3+、Mg2+和Ag+ |
| B.用Ba(NO3)2溶液鉴别Cl—、SO2—4和CO2—3 |
| C.用核磁共振氢谱鉴别1-溴丙烷和2-溴丙烷 |
| D.用新制氢氧化铜悬浊液鉴别甲醛和甲酸甲酯 |
下列方法中,不能用于物质分离的是
| A.过滤 | B.蒸馏 | C.分液 | D.丁达尔效应 |
下列实验装置或操作正确的是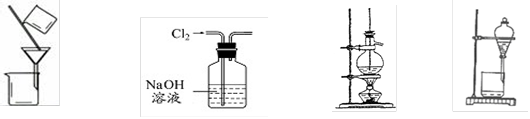
| A.分离NaCl溶液中CaCO3 | B.除去Cl2中含有的HCl | C.石油分馏 | D.分离乙醇和水 |
下列实验装置进行的相应实验,能达到实验目的的是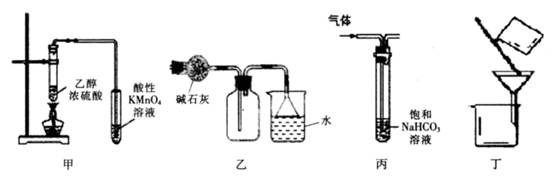
| A.装置甲可用于检验有乙烯生成 |
| B.装置乙可用于收集和吸收氨气 |
| C.装置丙可用于除去CO2中混有的HCl气体 |
| D.装置丁可用于除去溴苯中的溴 |
TiO2在工业生产和日常生活中有重要用途。
(1)工业上用钛矿石(FeTiO3,含FeO、Al2O3、SiO2等杂质)经过下述反应制得: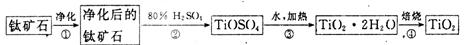
其中,步骤②发生的主要反应为:2H2SO4+FeTiO3 ="=" TOSO4(硫酸氧钛)+FeSO4+2H2O
净化钛矿石时,需用浓氢氧化钠溶液来处理。写出该过程中发生反应的化学方程式:________________。
步骤③中加热的目的是(请写出必要的化学方程式和文字): 。
(2)用TiO2制备金属钛的一种方法是先将TiO2与Cl2、C反应得到TiCl4,再用镁还原得到Ti。因下述反应难于发生:TiO2(s)+2Cl2(g)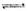 TiCl4(1)+O2(g) △H=+151 kJ/mol。所以不能直接由TiO2和Cl2反应(即氯化反应)来制取TiCl4,请说明判断该反应难以发生的理由是_______。当往氯化反应体系中加入碳后,反应在高温条件下能顺利进行生成TiCl4。
TiCl4(1)+O2(g) △H=+151 kJ/mol。所以不能直接由TiO2和Cl2反应(即氯化反应)来制取TiCl4,请说明判断该反应难以发生的理由是_______。当往氯化反应体系中加入碳后,反应在高温条件下能顺利进行生成TiCl4。
已知:C(s)+O2(g)=CO2(g) △H=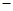 394 kJ/mol。
394 kJ/mol。
则TiO2(s)+C(s)+2Cl2(g)=TiCl4(1)+CO2(g) △H=________
从化学平衡的角度解释:往氯化反应体系中加入碳时,氯化反应能顺利进行的原因是_______________。
(3)下图是一种染料敏化太阳能电池的示意图。电池的一个由有机光敏染料(S)涂覆TiO2纳米晶体表面制成,另一电极由导电玻璃镀铂构成,电池中发生的反应为:
TiO2/S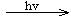 TiO2/S*(激发态)
TiO2/S*(激发态)
TiO2/S*  TiO2/S+ + e-
TiO2/S+ + e-
I3-+2e- 3I-
3I-
2TiO2/S*+I3-  2TiO2/S + I3-
2TiO2/S + I3-
下列关于该电池叙述正确的是
| A.电池工作时,I-离子在镀铂导电玻璃电极上放电 |
| B.电池工作时,是将太阳能转化为电能 |
| C.电池的电解质溶液中I-和I3- 浓度不会减少 |
| D.电池中镀铂导电玻璃为正极 |