题目内容
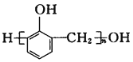
【题目】天门冬氨酸锌是一种补锌剂,可以![]() 、天门冬氨酸(
、天门冬氨酸(![]() )为原料制备。回答下列问题:
)为原料制备。回答下列问题:
(1)Zn成为阳离子时首先失去______轨道电子。碲(Te)与O同主族,则Te元素中电子占据的能量最高的能级是______。
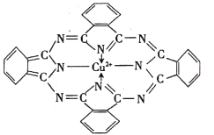
(2)P是N的同族元素,PH3与NH3中稳定性更高的是______(填化学式),其判断理由是______;酞菁铜可用于生产蓝色颜料(结构如图),其中C原子的轨道杂化类型为______。
(3)CO为______(填“极性”或“非极性”)分子。
(4)ZnO晶体的一种晶胞结构如图:
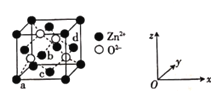
①![]() 的配位数为____________。
的配位数为____________。
②以晶胞边长为单位长度建立的坐标系可表示晶胞中锌原子的位置,称作原子分数坐标。图中原子a的分数坐标为![]() ,原子d的分数坐标为
,原子d的分数坐标为![]() ,则原子b和c的分数坐标分别为______、______。
,则原子b和c的分数坐标分别为______、______。
③设![]() 为阿伏加德罗常数的值。已知晶胞边长为
为阿伏加德罗常数的值。已知晶胞边长为![]() nm,则ZnO晶体的密度为______(列出计算式)
nm,则ZnO晶体的密度为______(列出计算式)![]() 。
。
【答案】4s 5p ![]() N原子半径更小,N-H键的键长更短,键能更大,故NH3更稳定 sp2 极性 4
N原子半径更小,N-H键的键长更短,键能更大,故NH3更稳定 sp2 极性 4 ![]()
![]()
![]()
【解析】
(1)根据原子的核外电子排布分析;
(2)根据分子的结构特点分析;根据杂化轨道理论分析
(4)根据配位数的概念和晶胞结构特点分析计算。
(1)Zn为65号元素,其价电子排布式为[Ar]3d104s2,其成为阳离子时首先失去4s轨道电子;碲(Te)与O同主族,其位于第五周期第VIA族,其价电子排布式为5s25p4,则Te元素中电子占据的能量最高的能级是5p;
(2)P是N的同族元素,由于N原子半径更小,N-H键的键长更短,键能更大,故NH3更稳定;酞菁铜中C原子均形成3个σ键,无孤电子对,故价层电子对数均为3,则C原子的的轨道杂化类型为sp2;
(3)CO为碳原子与氧原子间形成极性键的双原子分子,故其为极性分子;
(4)①由图可知,与![]() 距离最近且相等的Zn2+的个数为4,故其配位数为4;
距离最近且相等的Zn2+的个数为4,故其配位数为4;
②由图可知,原子b的坐标为![]() ,c的坐标为
,c的坐标为![]() ;
;
③由图可知,一个晶胞中![]() 的个数为4,Zn2+的个数为
的个数为4,Zn2+的个数为![]() ,则ZnO晶体的密度为
,则ZnO晶体的密度为![]() 。
。

【题目】利用下图装置做下面的实验:在烧杯中盛有半杯乙溶液,然后用滴定管向容器中滴入甲溶液。随着甲的滴入,灯泡逐渐变暗;滴到一定量时,灯泡熄灭,继续滴入甲溶液,灯泡又逐渐变亮。下列各组溶液中,能够产生上述现象的是 ( )
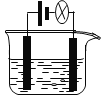
选项 | 甲 | 乙 |
A | NH3·H2O | HCl |
B | CH3COOH | NH3·H2O |
C | NaOH | MgCl2 |
D | H2SO4 | Ba(OH)2 |
A.AB.BC.CD.D
【题目】下列有关实验操作与现象相匹配的是( )
选项 | 实验操作 | 现象 |
A | 将石蜡油分解得到的产物直接通入少量溴的CCl4溶液中 | 无明显现象 |
B | 将浓硫酸和蔗糖反应产生的气体通入少量的 | 气体全部被吸收且溶液紫红色变浅 |
C | 向淀粉碘化钾溶液中通入过量氯气 | 溶液先变蓝后褪色 |
D | 向 | 无沉淀生成 |
A.AB.BC.CD.D
【题目】X、Y、Z、W为短周期主族元素,它们的最高正化合价和原子半径如下表所示:
元素 | X | Y | Z | W |
最高正化合价 | +3 | +1 | +5 | +7 |
原子半径 | 0.082 | 0.186 | 0.110 | 0.099 |
则下列说法错误的是
A.X的最高价氧化物对应的水化物具有两性
B.ZW3分子中所有原子最外层均满足8e-结构
C.Y的一种氧化物可用作供氧剂,Z的一种氧化物可用作干燥剂
D.简单气态氢化物的热稳定性:W>Z>X