题目内容
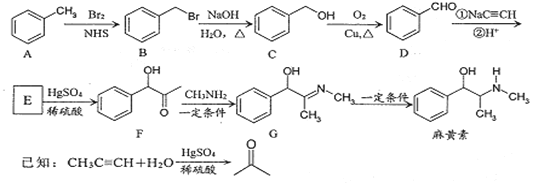
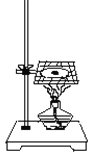
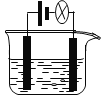
【题目】利用下图装置做下面的实验:在烧杯中盛有半杯乙溶液,然后用滴定管向容器中滴入甲溶液。随着甲的滴入,灯泡逐渐变暗;滴到一定量时,灯泡熄灭,继续滴入甲溶液,灯泡又逐渐变亮。下列各组溶液中,能够产生上述现象的是 ( )
选项 | 甲 | 乙 |
A | NH3·H2O | HCl |
B | CH3COOH | NH3·H2O |
C | NaOH | MgCl2 |
D | H2SO4 | Ba(OH)2 |
A.AB.BC.CD.D
【答案】D
【解析】
电解质溶液的导电性主要与溶液中自由移动的离子浓度和离子所带的电荷以及离子的移动速率有关,浓度越大,所带电荷越多,移动速度越快,导电能力越强。
A.向盐酸HCl中滴加氨水NH3·H2O,原溶液中存在HCl=H++Cl-,加入氨水后反应为NH3·H2O+HCl=NH4Cl+H2O,则NH4Cl=![]() +Cl-,故溶液中自由移动的离子浓度基本不变,灯泡亮度基本不变,随着氨水的加入,离子浓度减小,灯泡变暗,A不合题意;
+Cl-,故溶液中自由移动的离子浓度基本不变,灯泡亮度基本不变,随着氨水的加入,离子浓度减小,灯泡变暗,A不合题意;
B.向NH3H2O中滴加CH3COOH,生成醋酸铵强电解质,溶液中离子浓度增大,电灯渐渐变暗亮,滴到一定量后,继续滴入甲溶液,离子浓度因稀释而减小,电灯又会逐渐变暗,B不合题意;
C.向MgCl2中滴加NaOH,原溶液中存在MgCl2=Mg2++2Cl-,加入NaOH后反应为2NaOH+MgCl2=Mg(OH)2↓+2NaCl,则NaCl=Na++Cl-,此过程中溶液中自由移动的离子浓度基本不变,灯泡亮度基本不变,随着NaOH的加入,离子浓度因稀释而减小,灯泡变暗,C不合题意;
D.向Ba(OH)2中滴加H2SO4,一开始生成沉淀,电灯渐渐变暗甚至熄灭,后来硫酸过量时,电灯又渐渐变亮,D符合题意;
故答案为:D。

练习册系列答案
相关题目