题目内容
【题目】阿伏加德罗常数为NA。关于 l00mLl mol/L的Fe2(SO4)3溶液,下列说法正确是
A.加NaOH可制得Fe(OH)3 胶粒0.2NA
B.溶液中阳离子数目为0.2NA
C.加Na2CO3 溶液发生的反应为 3CO32-+ 2Fe3+ = Fe2(CO3 )3↓
D.Fe2(SO4)3溶液可用于净化水
【答案】D
【解析】
A. Fe2(SO4)3加NaOH反应生成Fe(OH)3沉淀,而不是胶粒,故A错误;
B. l00mL l mol/L的Fe2(SO4)3溶液中n[Fe2(SO4)3] =1 molL1 ×0.1L =0.1mol,n(Fe3+)=0.2mol,铁离子水解 Fe3+ + 3H2O ![]() Fe(OH)3 + 3H+,根据水解方程式得到溶液中阳离子数目大于0.2NA,故B错误;
Fe(OH)3 + 3H+,根据水解方程式得到溶液中阳离子数目大于0.2NA,故B错误;
C. 加Na2CO3溶液发生双水解生成氢氧化铁沉淀和二氧化碳气体,其反应为 3CO32+ 2Fe3+ + 3H2O =2 Fe(OH)3↓ + 3CO2↑,故C错误;
D. Fe2(SO4)3溶液水解生成胶体,胶体具有吸附杂质功能,起净水功能,因此可用于净化水,故D正确。
综上所述,答案为D。

【题目】碳、磷、硫等元素形成的单质和化合物在生活、生产中有重要的用途。
(1)下列氮原子的电子排布图表示的状态中,能量由低到高的顺序是____(填字母)。
A. ![]()
B. ![]()
C. ![]()
D. ![]()
(2)P4S3可用于制造火柴,其分子结构如图所示:
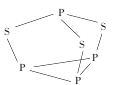
①P4S3分子中硫原子的杂化轨道类型为____。
②每个P4S3分子中含有的孤电子对的数目为____对。
(3)科学家合成了一种阳离子“N5n+”,其结构是对称的,5个N排成“V”形,每个N都达到8电子稳定结构,且含有2个氮氮三键,此后又合成了一种含有“N5n+”的化学式为“N8”的离子晶体(该晶体中每个N原子都达到了8电子稳定结构),N8的电子式为____。(CN)2中键与键之间的夹角为180°,并有对称性,分子中每个原子的最外层均满足8电子稳定结构,其结构式为____。
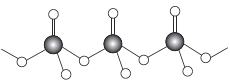
(4)直链多磷酸根阴离子是由两个或两个以上磷氧四面体通过共用顶角氧原子连接起来的,其结构如图所示。则由n个磷氧四面体形成的这类磷酸根离子的通式为____。
(5)碳酸盐中的阳离子不同,热分解温度就不同。下表为四种碳酸盐的热分解温度和对应金属阳离子的半径。随着金属阳离子半径的增大,碳酸盐的热分解温度逐渐升高,原因是 ___。
碳酸盐 | MgCO3 | CaCO3 | SrCO3 | BaCO3 |
热分解温度/℃ | 402 | 900 | 1172 | 1360 |
金属阳离子半径/pm | 66 | 99 | 112 | 135 |
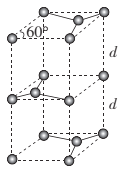
(6)石墨的晶胞结构如图所示。已知石墨的密度为ρg.cm-3,C-C键的键长为r cm,M为阿伏加德罗常数的值,则石墨晶体的层间距d= ___cm。