题目内容
【题目】苯甲酸是一种消毒防腐剂,其钠盐可抑制牙膏中微生物的生长。甲苯氧化法是实验室制备苯甲酸的常用方法之一。
(一)反应原理
C6H5CH3+2KMnO4![]() C6H5COOK+KOH+2MnO2↓+H2O
C6H5COOK+KOH+2MnO2↓+H2O
C6H5COOK+HCl→C6H5COOH+KCl
已知:苯甲酸相对分子质量122,熔点122.4℃;苯甲酸在水中的溶解度如下表。
温度/℃ | 17.5 | 25 | 75 | 80 | 100 |
溶解度/g | 3.00 | 3.99 | 5.90 | 8.39 | 11.7 |
(二)实验过程
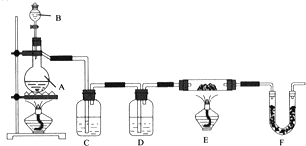
①将一定量甲苯、水、几粒沸石加入三颈烧瓶中;
②装上冷凝管,加热至沸后分批加入适量高锰酸钾,搅拌回流反应4小时;
③将反应混合物趁热减压过滤,并用热水洗涤滤渣,将洗涤液并入滤液中;
④滤液加入盐酸酸化后,抽滤(装置如图1)、洗涤、干燥得苯甲酸粗产品。
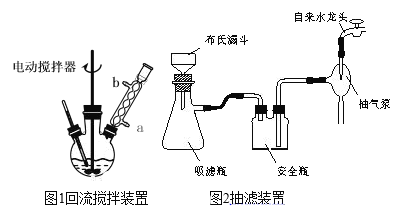
(1)图1电动搅拌器的作用是_____,冷凝管中冷水应从_____(填“a”或“b”)口进入;判断甲苯被氧化完全的实验现象是____。
(2)第③步抽滤操作时,要趁热进行,是因为_____,反应混合物趁热减压过滤后,若溶液呈红色,可用少量NaHSO3溶液处理,反应的离子方程式为_____。
(三)纯度测定
(3)称取1.22g产品溶解在甲醇中配成100mL溶液,移取25.00mL溶液,用KOH标准溶液进行滴定,消耗KOH的物质的量为2.30×10-3mol,产品中苯甲酸质量百分数为____(保留两位有效数字)。
(四)实验反思
(4)得到的粗产品要进一步提纯苯甲酸,可采用_____的方法。
【答案】加快反应速率,使反应更充分 a 由于甲苯被完全氧化后生成苯甲酸钾,甲苯层消失,回流液不再有明显的油珠出现 为苯甲酸在热水中的溶解度较大,趁热过滤并用热水洗涤,防止苯甲酸的损失 2MnO4-+3HSO3-+OH-=2MnO2↓+3SO42-+2H2O 92% 重结晶
【解析】
一定量的甲苯和适量的KMnO4溶液在100℃反应一段时间后停止反应,将反应混合物趁热减压过滤,并用热水洗涤滤渣,将洗涤液并入滤液中,滤液中主要含苯甲酸钾,盐酸酸化抽滤、洗涤、干燥得苯甲酸粗产品。
(1)图1电动搅拌器的作用是加快反应速率,使反应更充分;为确保冷凝效果,采用逆流法,冷凝管中冷水应从a(填“a”或“b”)口进入;判断甲苯被氧化完全的实验现象是由于甲苯被完全氧化后生成苯甲酸钾,甲苯层消失,回流液不再有明显的油珠出现。故答案为:加快反应速率,使反应更充分;a;由于甲苯被完全氧化后生成苯甲酸钾,甲苯层消失,回流液不再有明显的油珠出现。
(2)第③步抽滤操作时,要趁热进行,是因为苯甲酸在热水中的溶解度较大,趁热过滤并用热水洗涤,防止苯甲酸的损失;反应混合物趁热减压过滤后,若溶液呈红色,说明溶液中含有过量的高锰酸钾溶液,可用少量NaHSO3溶液处理,碱性高锰酸钾溶液与亚硫酸氢钠反应生成黑色沉淀MnO2,亚硫酸根被氧化为硫酸根,反应离子方程式为:2MnO4-+3HSO3-+OH-=2MnO2↓+3SO42-+2H2O。故答案为:为苯甲酸在热水中的溶解度较大,趁热过滤并用热水洗涤,防止苯甲酸的损失;2MnO4-+3HSO3-+OH-=2MnO2↓+3SO42-+2H2O;
(3)设苯甲酸的物质的量浓度为x,则25mL苯甲酸溶液中苯甲酸的物质的量=0.025xmol,
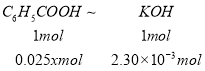
C6H5COOH+KOH→C6H5COOK+H2O
1mol 1mol
0.025xmol 2.30×10-3mol
1mol:1mol=0.025xmol:2.30×10-3mol
x=0.92,
则100mL苯甲酸中苯甲酸的质量=0.092mol·L-1×0.1L×122g·mol-1=1.1224g,
其质量分数=![]() ×100%=92%,
×100%=92%,
故答案为:92%;
(4)由苯甲酸在25℃和100℃时的溶解度分别为3.99g和11.7g,则苯甲酸的溶解度随着温度的升高变化较大,而氯化钾的溶解度随着温度的升高变化不大,所以除去产品中KCl用重结晶;。故答案为:重结晶。

 阅读快车系列答案
阅读快车系列答案