题目内容
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.加入Mg能放出H2的溶液:Na+、Al3+、Cl-、SO42- |
| B.常温下,c(H+)/c(OH-)=1010的溶液:Fe2+、K+、NO3-、SO42- |
| C.加入苯酚显紫色的溶液:NH4+、K+、Cl-、S2- |
| D.使甲基橙呈红色的溶液:NH4+、Na+、AlO2-、HCO3- |
A
解析试题分析:A.加入Mg能放出H2的溶液是酸性溶液,在酸性溶液中离子Na+、Al3+、Cl-、SO42-不会发生任何反应,能够电离共存。正确。B.常温下,c(H+)/c(OH-)=1010的溶液,c(H+)=0.01mol/L,是酸性溶液,在此溶液中会发生反应:3Fe2++NO3-+4H+= 3Fe3++NO↑+2H2O,不能电离共存,错误。C.加入苯酚显紫色的溶液含有Fe3+,此时会发生反应:2Fe3++3S2-=2FeS+S↓,不能电离共存。错误。D.使甲基橙呈红色的溶液呈酸性,此时会发生反应:4H++AlO2-=Al3++2H2O;H++HCO3-= CO2↑+H2O,不能电离共存,错误。
考点:考查离子能否大量共存的知识。

练习册系列答案
相关题目
下列表示对应化学反应的离子方程式正确的是
A.MnO2固体与浓盐酸反应制取Cl2:MnO2+4HCl Mn2++2Cl-+Cl2↑+2H2O Mn2++2Cl-+Cl2↑+2H2O |
| B.AlCl3溶液中滴加浓氨水至过量:Al3++4NH3·H2O=AlO2-+4NH4++2H2O |
| C.氯化亚铁溶液中加入硝酸:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑ |
D.NH4HCO3溶于过量的NaOH溶液中:HCO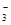 +OH-===CO +OH-===CO +H2O +H2O |
常温时,下列各组离子能大量共存的是
A.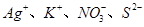 | B.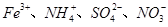 |
C.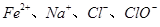 | D. |
用pH大小表示溶液的酸碱性相对强弱有许多不足之处。因此,荷兰科学家Henk Van Lubeck引入了酸度(AG)的概念,即把电解质溶液中的酸度定义为c(H+)与c(OH一)比值的对数,用公式表示为AG="lg" [c(H+)/c(OH一)] 。常温下,在AG=10的溶液中能大量共存的离子是:
| A.Ca2+、K+、Cl-、SO32- | B.NH4+、Fe2+、 I一、SO42- |
| C.Na+ 、K+、ClO-、S2- | D.Na+、S2O32-、AlO2—、K+ |
下列反应的离子方程式正确的是( )
| A.向AgNO3溶液中滴加氨水至过量:Ag++NH3·H2O=AgOH↓+NH4+ |
| B.向Mg(OH)2悬浊液中滴加FeCl3溶液:3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+ |
| C.向Na2S2O3溶液中加入足量稀硫酸:2S2O32-+4H+=SO42-+3S↓+2H2O |
D.向苯酚钠溶液中通入少量CO2气体: |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.能溶解Al2O3的溶液:Na+、K+、HCO3-、NO3- |
| B.0.1mol·L-1Ca(ClO)2溶液:K+、Na+、I-、Cl- |
| C.能使甲基橙显红色的溶液:K+、Fe2+、Cl-、NO3- |
| D.加入KSCN显红色的溶液:Na+、Mg2+、Cl-、SO42- |
下列物质属于电解质的是
| A.硫酸氢钠 | B.铜 | C.氯气 | D.氨 |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.0.1 mol·L-1 NaHSO4溶液:K+、Fe2+、NO3-、Cl- |
| B.0.1 mol·L-1NaAlO2的溶液:K+、Na+、SO42-、CO32- |
| C.无色溶液:Ba 2+、Na+、MnO4-、NO3- |
| D.由水电离出的c(OH-)=1.0×10-12 mol·L-1的溶液:NH4+、HCO3-、Na+、Cl- |
下列反应的离子方程式中,正确的是
| A.NH4HCO3溶液与过量NaOH溶液反应:NH4+ + OH- = NH3·H2O |
| B.在苯酚的乳浊溶液中滴加碳酸钠溶液变澄清:2C6H5OH + CO32- → CO2↑+ 2C6H5O- + H2O |
C.用两根铜棒作电极电解盐酸:2H+ + 2Cl-  H2↑ + Cl2↑ H2↑ + Cl2↑ |
| D.SO2通入次氯酸钠溶液中:SO2 + ClO-+ H2O = SO42- + Cl-+ 2H+ |