题目内容
用pH大小表示溶液的酸碱性相对强弱有许多不足之处。因此,荷兰科学家Henk Van Lubeck引入了酸度(AG)的概念,即把电解质溶液中的酸度定义为c(H+)与c(OH一)比值的对数,用公式表示为AG="lg" [c(H+)/c(OH一)] 。常温下,在AG=10的溶液中能大量共存的离子是:
| A.Ca2+、K+、Cl-、SO32- | B.NH4+、Fe2+、 I一、SO42- |
| C.Na+ 、K+、ClO-、S2- | D.Na+、S2O32-、AlO2—、K+ |
B
解析试题分析:AG="lg" [c(H+)/c(OH一)]=10,则c(H+)/c(OH一)=1010, c(H+)·c(OH一)=10-14,所以c(H+)=0.01mol/L,溶液显酸性.A.在酸性溶液中会发生反应:2H++ SO32-=H2O+SO2↑,不能大量共存;错误。B.在酸性溶液中,NH4+、Fe2+、 I一、SO42-不会发生任何反应,可以大量共存。正确。C.在酸性溶液中ClO-、S2-会发生氧化还原反应,不能大量共存。错误。D.在酸性溶液中S2O32-、AlO2—会发生离子反应,不能大量共存。错误。
考点:考查溶液中离子能否大量共存的知识。

练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目
下列离子方程式正确的是( )
| A.乙酸与碳酸钠溶液反应:2H++CO32—== CO2↑+H2O |
| B.醋酸溶液与新制氢氧化铜反应:CH3COOH+OH-→CH3COO-+H2O |
| C.苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O →2C6H5OH+CO32— |
D.甲醛溶液与足量的银氨溶液共热:HCHO+4[Ag(NH3)2]++4OH- CO32—+2NH4++4Ag↓+6NH3+2H2O CO32—+2NH4++4Ag↓+6NH3+2H2O |
下列表示对应化学反应的离子方程式正确的是
| A.向铁粉中加入足量稀硝酸:2Fe+6H+=2Fe3++3H2↑ |
| B.向AlCl3溶液中滴加浓氨水至过量:Al3++4OH-=AlO2-+2H2O |
| C.向NaIO3溶液中加入适量NaHSO3溶液:IO3-+3HSO3-=I-+3SO42-+3H+ |
| D.向NH4HCO3溶液中滴加过量NaOH溶液:NH4++HCO3-+2OH-=CO32-+NH3·H2O |
根据下图的转化关系判断下列说法正确的是(反应条件已略去)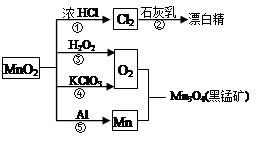
| A.反应①②③④⑤均属于氧化反应和离子反应 |
| B.反应⑤说明该条件下铝的还原性强于锰 |
| C.相同条件下生成等量的O2,反应③和④转移的电子数之比为1:1 |
| D.反应①中氧化剂与还原剂的物质的量之比为1:4 |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.加入Mg能放出H2的溶液:Na+、Al3+、Cl-、SO42- |
| B.常温下,c(H+)/c(OH-)=1010的溶液:Fe2+、K+、NO3-、SO42- |
| C.加入苯酚显紫色的溶液:NH4+、K+、Cl-、S2- |
| D.使甲基橙呈红色的溶液:NH4+、Na+、AlO2-、HCO3- |
下列离子组在一定条件下能大量共存,当加入相应试剂后会发生化学变化,且所给离子方程式正确的是 ( )
| 选项 | 离子组 | 加入试剂 | 加入试剂后发生反应的离子方程式 |
| A | Fe2+、NO 、K+ 、K+ | 稀硫酸 | 3Fe2++NO +4H+=3Fe3++NO↑+2H2O +4H+=3Fe3++NO↑+2H2O |
| B | Fe3+、I-、ClO- | 氢氧化钠溶液 | Fe3++3OH-=Fe(OH)3↓ |
| C | Ba2+、HCO 、Cl- 、Cl- | 氢氧化钠溶液 | HCO + OH-=CO + OH-=CO +H2O +H2O |
| D | Al3+、Cl-、NO | 过量氢氧化钠溶液 | Al3++3 OH-=Al(OH)3↓ |
下列表示对应化学反应的离子方程式正确的是 ( )
| A.向银氨溶液中滴加乙醛: CH3CHO +2[Ag(NH3)2]+ + H2O  CH3COO- + NH4+ +3NH3 + 2Ag↓+2H+ CH3COO- + NH4+ +3NH3 + 2Ag↓+2H+ |
B.苯酚钠溶液中通入少量CO2: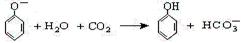 |
| C.硫酸氢铵溶液中滴加少量NaOH溶液:H++NH4++2OH-=NH3·H2O+H2O |
| D.氯乙酸与足量的氢氧化钠溶液共热:CH2ClCOOH+OH—△CH2ClCOO—+H2O |
下列说法正确的是
| A.有化学键断裂的过程一定发生化学变化 |
| B.氯化钠是一种电解质,电解饱和食盐水可制得金属钠 |
| C.将pH=a的醋酸稀释为pH=a + 1的过程中,c(CH3COOH) / c(H+)减小 |
| D.SiO2是酸性氧化物,能与强碱溶液反应,但不与任何酸反应 |
常温下,下列离子或分子在指定溶液中能大量共存的一组是
| A.FeCl3饱和溶液:K+、I一、Cl-、H+ |
| B.使紫色石蕊试液变蓝色的溶液:Na+、NO3-、Br一、NH3.H2O |
| C.pH=l的溶液:Cr2O72-、K+、NO3-、C2H5OH |
| D.能溶解Al2O3的溶液:Na+、Mg2+、HCO3-、Cl- |