题目内容
【题目】氮氧化物和硫氧化物是常见的空气污染物,含氮氧化物和硫氧化物的尾气需处理后才能排放。
Ⅰ.氮氧化物的处理
(1)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为_________。
(2)NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应为NO+NO2+2OH=2NO2-+H2O,2NO2+2OH= NO2-+NO3-+H2O,吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是_________(填化学式)。
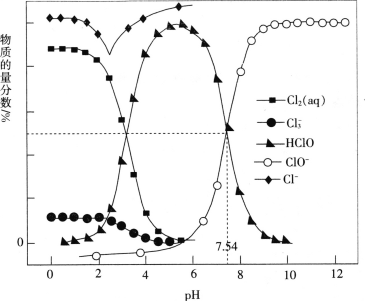
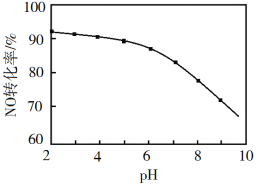
(3)NO的氧化吸收。在酸性NaClO溶液中,HClO氧化NO生成Cl和NO3-。其他条件相同,NO转化为NO3-的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。NaClO溶液的初始pH越小,NO转化率越高。其原因是_________。
Ⅱ.煤燃烧排放的烟气中SO2和NOx的处理
采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。在鼓泡反应器中通入含有SO2和NOx的烟气,反应温度为323K,NaClO2溶液浓度为5×103mol·L1 。反应一段时间后溶液中离子浓度的分析结果如下表。
离子 | SO42 | SO32 | NO3 | NO2 | Cl |
c/(mol·L1) | 8.35×104 | 6.87×106 | 1.5×104 | 1.2×105 | 3.4×103 |
(4)写出NaClO2溶液脱硫过程中主要反应的离子方程式________。增加压强,NO的转化率_________(填“提高”“不变”或“降低”)。
(5)由实验结果可知,脱硫反应速率大于脱硝反应速率。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是_________。
【答案】2NH3+2O2![]() N2O+3H2O NaNO3 溶液pH越小,溶液中HClO的浓度越大,氧化NO的能力越强 2SO2+ClO2-+4OH-=2SO42-+2H2O+Cl- 提高 NO溶解度较低或脱硝反应活化能较高
N2O+3H2O NaNO3 溶液pH越小,溶液中HClO的浓度越大,氧化NO的能力越强 2SO2+ClO2-+4OH-=2SO42-+2H2O+Cl- 提高 NO溶解度较低或脱硝反应活化能较高
【解析】
(1)NH3与O2在加热和催化剂作用下生成N2O,同时生成水;
(2)反应生成NaNO2和NaNO3;
(3)NaClO溶液的初始pH越小,HClO的浓度越大,氧化能力强;
(4)亚氯酸钠具有氧化性,则NaClO2溶液脱硫过程中将SO2氧化为SO42-,ClO2-被还原为Cl-,结合电子守恒、电荷守恒及原子守恒书写方程式;正反应是体积减小的反应,则增加压强,NO的转化率提高;
(5)由实验结果可知,在相同时间内硫酸根离子的浓度增加的多,因此脱硫反应速率大于脱硝反应速率,原因是除了SO2和NO在烟气中的初始浓度不同,还可能是二氧化硫的还原性强,易被氧化,还可能是NO溶解度较低或脱硝反应活化能较高。
(1)NH3与O2在加热和催化剂作用下发生氧化还原反应生成N2O和水,反应的化学方程式为2NH3+2O2![]() N2O+3H2O;
N2O+3H2O;
(2)根据气体的成分及发生的反应可知,反应生成NaNO2和NaNO3,所以吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是NaNO3;
(3)NaClO溶液的初始pH越小,则NaClO与溶液中的H+结合形成的HClO的浓度就越大,HClO的浓度越大,其氧化能力强,因此可提高NO转化率;
(4)亚氯酸钠具有氧化性,则NaClO2溶液脱硫过程中将SO2氧化为SO42-,ClO2-被还原为Cl-,结合电子守恒、电荷守恒及原子守恒书写方程式为:2SO2+ClO2-+4OH-=2SO42-+2H2O+Cl-;脱硝反应的正反应是气体体积减小的反应,根据平衡移动原理:增加压强,平衡正向移动,所以NO的转化率提高;
(5)由实验结果可知,在相同时间内硫酸根离子的浓度增加的多,因此脱硫反应速率大于脱硝反应速率,原因是除了SO2和NO在烟气中的初始浓度不同,还可能是二氧化硫的还原性强,易被氧化,还可能是NO溶解度较低或脱硝反应活化能较高。