题目内容
【题目】A、B、C、D、E、F六种元素位于短周期,原子序数依次增大,C基态原子核外有三个未成对电子,B与D形成的化合物BD与C的单质C2电子总数相等,CA3分子结构为三角锥形,D与E可形成E2D与E2D2两种离子化合物,D与F是同族元素。根据以上信息,回答下列有关问题:
(1)写出基态时D的电子排布图________。
(2)写出化合物E2F2的电子式________,化合物ABC的结构式________。
(3)根据题目要求完成以下填空:
①BF32﹣中心原子杂化方式________;CA3中心原子杂化方式________;
②FD42﹣微粒中的键角________; FD3分子的立体构型________。
(4)F元素两种氧化物对应的水化物酸性由强到弱为__________,原因__________________。
【答案】![]()
![]() H-C≡N sp2 sp3 109°28′ 平面三角形 H2SO4> H2SO3 H2SO4中非羟基氧原子个数比H2SO3多,酸性强
H-C≡N sp2 sp3 109°28′ 平面三角形 H2SO4> H2SO3 H2SO4中非羟基氧原子个数比H2SO3多,酸性强
【解析】
A、B、C、D、E、F六种元素位于短周期,原子序数依次增大,C基态原子核外有三个未成对电子,且C能形成单质C2 ,所以C是N元素;B与D形成的化合物BD与C2电子总数相等,且C的原子序数大于B小于D,所以B是C元素,D是O元素;CA3 分子结构为三角锥形,且A的原子序数小于B,所以A是H元素;D与E可形成E2D 与E2D2 两种离子化合物,所以E是Na元素;D与F是同族元素,所以F是S元素。根据上述分析进行解答。
(1)通过以上分析知,D是O元素,原子核外有8个电子,其核外电子排布图为![]() ,
,
故答案为:![]() ;
;
(2)E2F2 为Na2S2 ,和过氧化钠类似,所以其电子式为:![]() ;化合物ABC是氢氰酸,结构式为 H-C≡N ,
;化合物ABC是氢氰酸,结构式为 H-C≡N ,
故答案为:![]() ; H-C≡N ;
; H-C≡N ;
(3) ①BF32﹣为CS32-,和CO32-相似,中心原子C的价层电子对数=3+0=3,中心原子杂化方式sp2;CA3为NH3,中心原子N的价层电子对数=3+1=4,中心原子杂化方式sp3,
故答案为:sp2 ;sp3;
②FD42- 为SO42-, S的价层电子对数=4+0=4,所以它的VSEPR模型为正四面体,因为没有孤电子对,所以其空间构型为正四面体,键角是109°28′;FD3 为SO3 ,S的价层电子对数=3+0=3,所以它的VSEPR模型为平面三角形,因为没有孤电子对,所以其空间构型为平面三角形,
故答案为:109°28′ ;平面三角形;
(4) S元素两种氧化物对应的水化物为H2SO4和H2SO3,同一种元素含氧酸中,含有非羟基O原子个数越多,其酸性越强,硫酸中非羟基氧原子个数为2、亚硫酸中非羟基氧原子个数是1,所以硫酸酸性强于亚硫酸,
故答案为:H2SO4> H2SO3 ;H2SO4中非羟基氧原子个数比H2SO3多,酸性强。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】氮氧化物和硫氧化物是常见的空气污染物,含氮氧化物和硫氧化物的尾气需处理后才能排放。
Ⅰ.氮氧化物的处理
(1)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为_________。
(2)NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应为NO+NO2+2OH=2NO2-+H2O,2NO2+2OH= NO2-+NO3-+H2O,吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是_________(填化学式)。
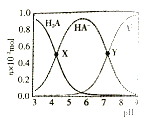
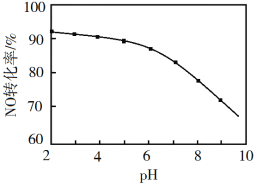
(3)NO的氧化吸收。在酸性NaClO溶液中,HClO氧化NO生成Cl和NO3-。其他条件相同,NO转化为NO3-的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。NaClO溶液的初始pH越小,NO转化率越高。其原因是_________。
Ⅱ.煤燃烧排放的烟气中SO2和NOx的处理
采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。在鼓泡反应器中通入含有SO2和NOx的烟气,反应温度为323K,NaClO2溶液浓度为5×103mol·L1 。反应一段时间后溶液中离子浓度的分析结果如下表。
离子 | SO42 | SO32 | NO3 | NO2 | Cl |
c/(mol·L1) | 8.35×104 | 6.87×106 | 1.5×104 | 1.2×105 | 3.4×103 |
(4)写出NaClO2溶液脱硫过程中主要反应的离子方程式________。增加压强,NO的转化率_________(填“提高”“不变”或“降低”)。
(5)由实验结果可知,脱硫反应速率大于脱硝反应速率。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是_________。
【题目】利用图示装置进行实验,反应进行足够长时间后装置II中实验现象正确的是
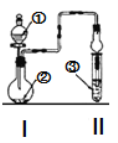
① | ② | ③ | II中实验现象 | |
A | 浓盐酸 | 大理石 | 氯化钡溶液 | 产生大量白色沉淀 |
B | 浓氨水 | 碱石灰 | 硫酸亚铁溶液 | 产生大量白色沉淀 |
C | 冰醋酸 | 乙醇和浓硫酸 | 饱和碳酸钠溶液 | 溶液分层,上层为油状液体 |
D | 浓盐酸 | KMnO4 | 氢硫酸 | 产生淡黄色沉淀 |
A.AB.BC.CD.D