题目内容
【题目】结合元素周期表回答下列问题:
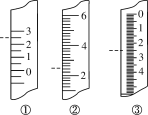
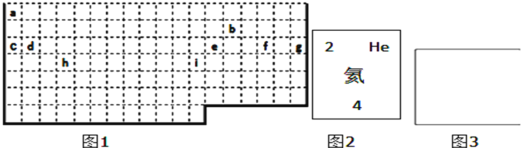
(1)①表中实线是元素周期表的部分边界,请在图1中用实线补全元素周期表的边界________
②请画出金属与非金属的分界线________
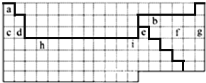
③请在方框中(图3)按氦元素的式样写出h元素原子的相关信息________
(2)X、Y、Z是周期表中相邻的三种短周期元素,X和Y同周期,Y和Z同主族,三种元素原子的最外层电子数之和为17,核内质子数之和为31。
①X是______, Z是______(填写元素名称)
②X, Y, Z 三种元素的简单离子半径大小顺序是_____________________________
③三种元素形成的单质氧化性最强的化学式为______
【答案】
 N S S2-> N3-> O2- O2
N S S2-> N3-> O2- O2
【解析】
根据元素周期表的结构可知,上边界为短周期元素,一周期有2种元素,位于1、18列,二、三周期有8种元素,位于1、2列及13~18列;h元素为钛元素;X、Y、Z是周期表中相邻的三种短周期元素,X和Y同周期,Y和Z同主族,三种元素核内质子数之和为31,平均质子数≈10.3,一定有元素处于第二周期,元素原子的最外层电子数之和为17,设X元素的最外层电子数为x,则Y、Z最外层电子数为x+1或x-1,若Y、Z元素的最外层电子数为x+1,则x+2(x+1)=17,解得x=5,符合题意,即X处于ⅤA族,Y、Z处于ⅥA族,则X为N元素,故Y为O元素、Z为S元素;若Y、Z元素的最外层电子数为x-1,则有x+2(x-1)=17,解得x= ![]() ,不符合题意
,不符合题意
(1)①上边界为短周期元素,一周期有2种元素,位于1、18列,二、三周期有8种元素,位于1、2列及13~18列,补全元素周期表的边界为: 。
。
②最外层电子数≤周期数为金属元素,最外层电子数>周期数为非金属性元素,画出金属与非金属的分界线为: 。
。
③h元素为钛元素,原子序数为22,符号为Ti,相对原子质量为51,其原子的相关信息可以表示为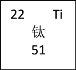 。
。
(2)①综上分析,X是N,Z是S。
②X, Y, Z 三种元素的简单离子为N3-、O2-、S2-,电子层数越多离子半径越大,电子层数相同时,核电荷数越大半径越小,则三种离子的半径大小顺序是S2-> N3-> O2-。
③同周期从左到右、同主族从下到上,非金属单质的氧化性逐渐增强,则三种元素形成的单质氧化性最强的化学式为O2。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】氮氧化物和硫氧化物是常见的空气污染物,含氮氧化物和硫氧化物的尾气需处理后才能排放。
Ⅰ.氮氧化物的处理
(1)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为_________。
(2)NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应为NO+NO2+2OH=2NO2-+H2O,2NO2+2OH= NO2-+NO3-+H2O,吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是_________(填化学式)。
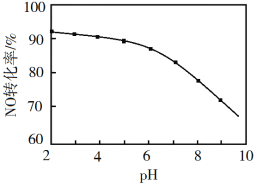
(3)NO的氧化吸收。在酸性NaClO溶液中,HClO氧化NO生成Cl和NO3-。其他条件相同,NO转化为NO3-的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。NaClO溶液的初始pH越小,NO转化率越高。其原因是_________。
Ⅱ.煤燃烧排放的烟气中SO2和NOx的处理
采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。在鼓泡反应器中通入含有SO2和NOx的烟气,反应温度为323K,NaClO2溶液浓度为5×103mol·L1 。反应一段时间后溶液中离子浓度的分析结果如下表。
离子 | SO42 | SO32 | NO3 | NO2 | Cl |
c/(mol·L1) | 8.35×104 | 6.87×106 | 1.5×104 | 1.2×105 | 3.4×103 |
(4)写出NaClO2溶液脱硫过程中主要反应的离子方程式________。增加压强,NO的转化率_________(填“提高”“不变”或“降低”)。
(5)由实验结果可知,脱硫反应速率大于脱硝反应速率。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是_________。