题目内容
【题目】要使氯化铝中的铝离子完全转化成氢氧化铝沉淀,应选的最佳试剂( )
A. 氢氧化钠溶液 B. 稀盐酸 C. 硝酸银溶液 D. 氨水
【答案】D
【解析】A、氢氧化钠溶液是强碱溶液,沉淀Al3+时生成的氢氧化铝能溶解在过量的强碱溶液中,所以Al3+不能全部沉淀出来,A错误;B、稀盐酸与氯化铝不反应,B错误;C、硝酸银溶液能和氯化铝反应生成氯化银和硝酸铝,不能得到氢氧化铝,C错误;D、氨水是弱碱溶液,可以加入过量氨水,全部沉淀Al3+,且氢氧化铝不溶于弱碱氨水溶液,D正确;答案选D。

 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案【题目】氮气和氮的化合物在工农业上生产、生活中有重要的用途。
(1)N2在空气中含量约78%,其性质稳定,可作保护气,常温下不与O2发生反应,但在闪电或者高温条件下可发生反应,标准装况下11.2L氮气与氧气反应吸收90kJ热量。
①写出N2与O2在放电条件下的热化学反应方程式_________。
② 根据NO的性质,收集NO气体的正确方法是_______。(填“排水法”、“向上排空气法”或“向下排空气法”)
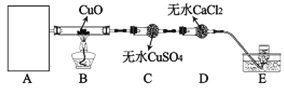
(2)为探究NH3的还原性,某实验小组设计了如下实验装置,其中A为NH3的制取装置。
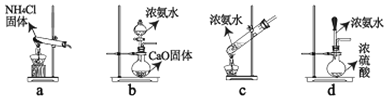
①下面是实验室制取NH3的装置和选用的试剂,其中不合理的是(____)
②选取合理的NH3的制取装置,小组开始实验,并发现了如下现象,同时小组对现象进行了讨论并得出了相应的结论:
序号 | 现象 | 结论 |
I | B装置中黑色氧化铜变为红色 | 反应生成了Cu或Cu2O |
II | C装置中无水CuSO4变蓝 | 反应生成了H2O |
III | E装置中收集到无色无味气体 | 反应生成了N2 |
分析上面的实验现象及结论,其中不合理的是______(填序号),原因是________。
(3)亚硝酸盐既有氧化性、又有还原性,常见的亚硝酸盐均有毒,但NaNO2是一种食品添加剂,使用时必须严格控制其用量。
在酸性溶液中,NaNO2能使淀粉-KI溶液变蓝色(同时得到一种常见的气体化合物),也能使酸性KMnO4溶液褪色,则前者反应过程中消耗的氧化剂与生成的氧化产物物质的量之比为_______,后者反应的离子方程式为__________。



