题目内容
12.下列物质不能用于干燥SO2气体的是( )| A. | 浓硫酸 | B. | 碱石灰 | C. | 无水氯化钙 | D. | 五氧化二磷 |
分析 二氧化硫为酸性气体,能够与碱性物质如氢氧化钠、氧化钙反应,据此解答.
解答 解:能用于干燥SO2气体需满足不能与二氧化硫发生反应,二氧化硫为酸性气体,能够与碱性物质如氢氧化钠、氧化钙反应,所以不能用碱石灰干燥,可以用浓硫酸、无水氯化钙、五氧化二磷干燥,
故选:B.
点评 本题考查了干燥剂的选择,明确二氧化硫的性质及干燥剂的性质是解题关键,题目难度不大.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
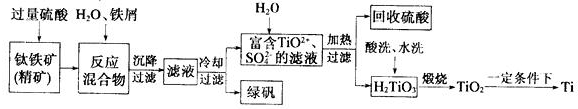
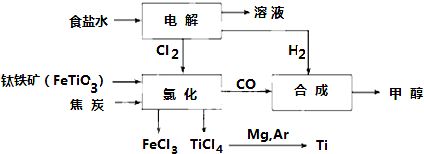
3.钛冶炼厂与氯碱厂、甲醇厂组成一个产业链(如图所示),将大大提高资源的利用率,减少环境污染.
请回答下列问题:
(1)Fe位于元素周期表中第四周期第VIII族.
(2)写出钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式2FeTiO3+6C+7Cl2$\frac{\underline{\;高温\;}}{\;}$2FeCl3+2TiCl4+6CO
(3)制备TiO2的方法之一是利用TiCl4水解生成TiO2•xH2O,再经焙烧制得.写出TiCl4水解的化学方程式:TiCl4+(2+x)H2O=TiO2.xH2O↓+4HCl.
(4)反应后得到Mg、MgCl2、Ti的混合物,可采用蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于1412℃即可.
(5)电解食盐水的离子方程式:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑.

请回答下列问题:
(1)Fe位于元素周期表中第四周期第VIII族.
(2)写出钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式2FeTiO3+6C+7Cl2$\frac{\underline{\;高温\;}}{\;}$2FeCl3+2TiCl4+6CO
(3)制备TiO2的方法之一是利用TiCl4水解生成TiO2•xH2O,再经焙烧制得.写出TiCl4水解的化学方程式:TiCl4+(2+x)H2O=TiO2.xH2O↓+4HCl.
(4)反应后得到Mg、MgCl2、Ti的混合物,可采用蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于1412℃即可.
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
7.将相同的物质的量浓度的某弱酸HX溶液与NaX溶液人等体积混合后,测得混合后溶液中c(Na+)>c (X-),则下列关系错误的是( )
| A. | c (H+)<c (OH-) | B. | c (HX )<c (X-) | ||
| C. | c (X-)+c(HX )=2c (Na+) | D. | c (X-)-c (HX)═2(c( OH-)-c (H+)) |
4.X、Y、Z M.N是原子序数依次增大的五种短周期主族元素.其相关信息如下表所示.
(1)M位于元素周期表第四周期ⅥA族,单质M的氧化性比单质Y的氧化性弱(填“强”或“弱”)
(2)X、Z可形成化合物ZX,ZX的电子式为Na+[:H]-(用元素符号表示),ZX与盐酸反应.每生成1molX2时转移电子的物质的量为1mol
(3)实验室中检验N的简单离子的试剂是稀硝酸和硝酸银溶液,反应的离子方程式为Ag++Cl-=AgCl↓
(4)M的氢化物5.6L(标准状况下)完全燃烧生成气态氧化物后恢复到室温,放出的热量为127.6kJ,该条件下反应的热化学方程式为2H2S(g)+3O2(g)=2SO2(g)+2H2O(l)△H=-510.4kJ/mol.
| 元素 | 相关信息 |
| X | 所有元素中原子半径最小的元素 |
| Y | 地壳中含量最多的元素 |
| Z | 短周期中原子半径最大的金属元素 |
| M | 与Y同主族 |
(2)X、Z可形成化合物ZX,ZX的电子式为Na+[:H]-(用元素符号表示),ZX与盐酸反应.每生成1molX2时转移电子的物质的量为1mol
(3)实验室中检验N的简单离子的试剂是稀硝酸和硝酸银溶液,反应的离子方程式为Ag++Cl-=AgCl↓
(4)M的氢化物5.6L(标准状况下)完全燃烧生成气态氧化物后恢复到室温,放出的热量为127.6kJ,该条件下反应的热化学方程式为2H2S(g)+3O2(g)=2SO2(g)+2H2O(l)△H=-510.4kJ/mol.
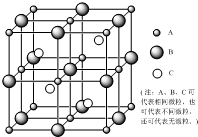 晶体的世界丰富多彩,晶体的结构纷繁复杂.人教版课程标准高中教材《选修3》向我们展示了一些典型晶体的结构及性质的相关知识,如:干冰、冰、金刚石、石墨、钋、钾、镁、铜、NaCl、CsCl、CaF2.下图是一个立方晶胞图,请大家在上述所列物质范围内回答下列问题:
晶体的世界丰富多彩,晶体的结构纷繁复杂.人教版课程标准高中教材《选修3》向我们展示了一些典型晶体的结构及性质的相关知识,如:干冰、冰、金刚石、石墨、钋、钾、镁、铜、NaCl、CsCl、CaF2.下图是一个立方晶胞图,请大家在上述所列物质范围内回答下列问题: