��Ŀ����
����Ŀ��ʳ�����ճ�����ı���Ʒ��Ҳ����Ҫ�Ļ���ԭ�ϡ���ʳ�γ���������Ca2+��Mg2+��Fe3+��SO42-���������ӣ�ʵ�����ᴿNaC1���������£�
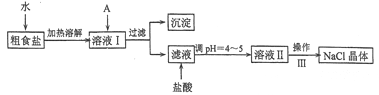
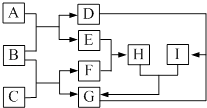
��1������A�Լ�����Ϊ�˳�ȥ��ҺI�е�Ca2+��Mg2+��Fe3+��SO42-���ӡ�A�������Ƕ����Լ������μ�˳������Ϊ:iNaOH,��__________,��_________(�ѧʽ)��
��2����д�������Լ������Լ�iʱ������Ҫ��Ӧ�����ӷ�Ӧ����ʽ��_________
��3������ͼ��ijѧ���Ĺ��˲���ʾ��ͼ����������淶����________(����)��
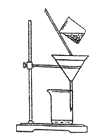
a.©��ĩ�˾���δ�����ձ���
b.��������������
c.����ֽʪ��ʹ�����©����
d.��ֽ��Ե�߳�©��
e.�ò�������©������������Լӿ�����ٶ�
��4������III��������__________
��5��mg�����ᴿ��õ�ng������NaCl���壬��m��n�Ĵ�С��ϵΪ_________.
A.m>n B. m=n C. m<n D. ��ȷ��.
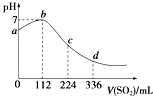
��6��ʵ����������480 mL0.400mol/L���ᣬ������ͼ��ʾŨ�������ƣ��ش���������:
����
����ʽ: HCl
��Է�������: 36.5
�ܶ�: 1.2g/cm3
HCl����������Ϊ: 36.5%
��������Ҫ�IJ��������в������������ձ���________(����������)
������ȡŨ��������Ϊ:__________mL��(�������1λС��)
���𰸡� BaCl2 Na2CO3 Mg2+ + 2OH-=Mg(OH)2�� Fe3+ + 3OH-=Fe(OH)3�� de �����ᾧ D ��ͷ�ι� 500 mL ����ƿ 16.7mL
��������(1). ���ӹ�����ͨ����������ij����Լ�����Ҫ�������µ����ʣ�����ע���Ⱥ�˳����������ӿ����ñ����ӳ�ȥ����������̼������ӳ�ȥ��ͬʱ̼�������Ҳ���Գ�ȥ����ı����ӣ������ȼ��Ȼ��������̼���ơ��ʴ�Ϊ��BaCl2 ��Na2CO3 ��2�������������ƣ���þ���ӷ�Ӧ����������þ�������������ӷ�Ӧ���������������������ӷ���ʽΪ��Mg2+ + 2OH-=Mg(OH)2�� �� Fe3+ + 3OH-=Fe(OH)3�� ����3���ڹ���ʱע��һ��������������ֽ����©���ڱڣ���ֽ��Ե����©����Ե��Һ�������ֽ��Ե������������������ֽһ�࣬�ձ����ڲ�������������©���¶˾�������ձ��ڱڣ�ͬʱ���������ܽ��н��裬������d��e���淶�� ��4��������Ϊ���Ȼ�����Һ�еõ��Ȼ��ƹ��壬Ϊ�����ᾧ�� ��5��.�ڴ����ᴿ�����м����������Ӻ������ӣ����Բ���ȷ��ǰ���������ϵ���ʴ�Ϊ�� D����6��������һ�����ʵ���Ũ�ȵ���Һ��Ҫʹ�õ�������һ����������ƿ���ձ���������������ιܣ���Ͳ�ȣ�����ȱ�ٵ�Ϊ ��ͷ�ιܺ�500 mL ����ƿ������Ҫ����500mL��Һ��������Ҫ�������������㹫ʽΪ![]() ���ʴ�Ϊ��16.7mL��
���ʴ�Ϊ��16.7mL��