��Ŀ����
����Ŀ����ѧ�����������ߣ��������ǵ��ճ�����������أ���Ҫ��ش��������⣺
��1��ȱ����ƶѪ����Ӧ����Fe2����ͨ����������������ʽ���䣬��������������ҩЧ���������������Ƴ�ҩƬʱ�������һ����������£�������µ�������_________________.
��2�������γ���д����������ʽ���س�ʯ��K2Al2Si6O16��д�����������ʽΪ____________.
��3��Ư�۾�����Ч�ɷֵĻ�ѧʽΪ_________________.
��4����������������ǽ������ϵ����ǣ����й㷺Ӧ�õĹ��ά�ɷ���_____________________
��5���մɡ�ˮ��Ͳ����dz��õĴ�ͳ�����ǽ������ϣ�����������ͨ��������Ҫԭ����_________������������Һ�����ò�������ԭ���ǣ���ѧ����ʽ��_________________.
��6������ǵ�ˮ�м�������KAl(SO4)212H2O��ˮ�ɵõ�������д��������ˮ�еĵ��뷽��ʽ_______����������Һ����μ���Ba(OH)2��Һֱ��Al3+ǡ�ó�����ȫ��������Ӧ�����ӷ���ʽΪ_________________ .
��7������ˮ�е�NO3-�����ཡ������Σ����Ϊ�˽�������ˮ��NO3-��Ũ�ȣ������ڼ��������������۽�NO3-��ԭΪN2���仯ѧ����ʽΪ��10Al+6NaNO3+4NaOH�T10NaAlO2+3N2��+2H2O��
��ش��������⣺
���ڻ�ѧ����ʽ���õ����ű���÷�Ӧ�е���ת�Ƶķ������Ŀ��_________________.
��������Ӧ�������ɱ����3.36L N2����ת�Ƶĵ�����ĿΪ��_________________.
���𰸡���ֹ�������������� K2O��Al2O3��6SiO2 Ca(ClO)2 SiO2 ���ʯӢ��ʯ��ʯ SiO2+2NaOH=Na2SiO3+H2O KAl(SO4)2=K++Al3++2SO42- 2Al3++3Ba2++6OH-+3SO42-=2Al(OH)3��+3BaSO4�� 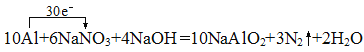 1.5NA
1.5NA
��������
��1������FeSO4���ȶ����ڿ������ױ��������������з�������2����������д����������ʽ�Ĺ��ɼ����ý���������д��ǰ�ߣ��Դ�������ɣ���3������Ư�۵���ȡԭ�����н�𣻣�4������������ˮ��������������������Ծ�ˮ��ԭ��������𣻣�5������������ԭ��Ӧ��ʧ�����غ���н��
��1��FeSO4�ױ����������ʣ����¿�����FeSO4���������е����������������������һ����������£��ʴ�Ϊ:����FeSO4���������е�����������
��2�������γ���д����������ʽ���س�ʯ��K2Al2Si6O16��д�����������ʽ˳��Ϊ�����ý���������д��ǰ�ߣ��Դ����Ƽ�����д��K2O��Al2O3��6SiO2 ���𰸣�K2O��Al2O3��6SiO2��
��3��������Ca(OH)2��Ӧ����CaCl2��Ca(ClO)2��ˮ����Ӧ�ķ���ʽΪ2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O�������Ȼ��ƺʹ�����ƵĻ����ΪƯ�۵���Ҫ�ɷ֣��Ȼ�����Ư�����ã�����Ư�۵���Ч�ɷ�Ϊ������ƣ�������ǿ�����Զ���ɱ������������,��Ч�ɷֵĻ�ѧʽΪCa(ClO)2;�𰸣�Ca(ClO)2��
��4�����ά�ijɷ�Ϊ�������裬�仯ѧʽΪSiO2���𰸣�SiO2��
��5���մɡ�ˮ��Ͳ����dz��õĴ�ͳ�����ǽ������ϣ���ͨ��������ȡ�Ǵ��ʯ��ʯ�ֱ��ڸ��µ������º�ʯӢ��Ӧ�����ɹ����ƺ���ơ�����������ͨ��������Ҫԭ���д��ʯӢ��ʯ��ʯ����Ϊ����������Һ��SiO2��Ӧ������װ����������Һ���Լ�ƿ�����ò��������仯ѧ��Ӧ����ʽΪ��SiO2+2NaOH=Na2SiO3+H2O��Na2SiO3����ճ���ԣ��𰸣����ʯӢ��ʯ��ʯ��SiO2+2NaOH=Na2SiO3+H2O��
��6��������ˮ��Һ�е��뷽��ʽΪKAl(SO4)2=K++Al3++2SO42-����������Al3+��SO42-�����Ժ� Ba(OH)2��Ӧ������KAl(SO4)2Ϊ2mol,��Һ�к���2molAl3+��4molSO42-����2molAl3+ǡ��ȫ������ʱ����Ҫ6molOH-��������3molBa(OH)2����Ӧ�����ӷ���ʽΪ��2Al3++3Ba2++6OH-+3SO42-=2Al(OH)3��+3BaSO4��;�ʴ�Ϊ:KAl(SO4)2=K++Al3++2SO42-��2Al3++3Ba2++6OH-+3SO42-=2Al(OH)3��+3BaSO4��
��7������10Al+6NaNO3+4NaOH�T10NaAlO2+3N2��+2H2O��Ӧ��֪��Alʧ3�����ӱ��AlO2-��2NO3-��10�����ӱ��N2�������ݵ�ʧ�����غ��֪ת�Ƶĵ�������Ϊ30�������Ե���ת������Ϊ30e-���䷽��ʽΪ��![]() ���𰸣�
���𰸣�![]() ��
��
����10Al+6NaNO3+4NaOH�T10NaAlO2+3N2��+2H2O��Ӧ��֪������Ӧ�����ɱ����3.36L N2����ת�Ƶĵ�����ĿΪ��![]() 10NA=1.5NA;�𰸣�1.5NA��
10NA=1.5NA;�𰸣�1.5NA��

����Ŀ����25��ʱ��������ˮϡ��1mol��L-1�İ�ˮ��0.01mol��L-1��������Һ��ϡ�ͣ����и����ֵ��ʼ�ղ�����ǣ� ��
A.![]() B.
B.![]()
C.![]() D.
D.![]()
����Ŀ����ͼ��ʾ������������̽��NH3�����ʡ�ʵ��ʱ��NaOH�����ϵμ���Ũ��ˮ����������һ������������档�±��ж�ʵ�����������Ľ�����ȷ����(����)
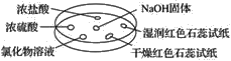
ѡ�� | ʵ������ | ���� |
A | Ũ���ḽ���������� | NH3��Ũ���ᷴӦ������NH4Cl���� |
B | Ũ���ḽ������������ | NH3��Ũ���������Ӧ |
C | �Ȼ�����Һ����� | ����Һһ����AlCl3��Һ |
D | �����ʯ����ֽ����ɫ��ʪ���ʯ����ֽ���� | NH3��һ�ֿ����Լ� |
A.AB.BC.CD.D