题目内容
3.现有部分短周期元素的性质或原子结构如下表:| 元素编号 | 元素性质或原子结构 |
| T | M层上的电子数是原子核外电子层数的2倍 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
| A. | 元素的非金属性:Z>T>X | |
| B. | 最高价氧化物对应水化物的酸性:T>Z | |
| C. | 气态氢化物的热稳定性:X>Y | |
| D. | 四种元素中原子半径最大的是Z |
分析 T的M层上的电子数是原子核外电子层数的2倍,应为S元素;
X最外层电子数是次外层的2倍,因此X次外层为2个电子,最外层为4个电子,是C元素;
Y单质是双原子分子,且其氢化物水溶液显碱性,可知Y是N元素;
元素Z最高正价是+7价,因此Z是Cl,以此解答该题.
解答 解:T的M层上的电子数是原子核外电子层数的2倍,应为S元素;X最外层电子数是次外层的2倍,因此X次外层为2个电子,最外层为4个电子,是C元素;
Y单质是双原子分子,且其氢化物水溶液显碱性,可知Y是N元素;元素Z最高正价是+7价,因此Z是Cl,
A.由元素在周期表中的位置可知非金属性Cl>S,碳酸为弱酸,C的非金属性最小,故A正确;
B.非金属性Cl>S,元素的非金属性越强,对应的最高价氧化物对应水化物的酸性越强,故B错误;
C.非金属性N>C,元素的非金属性越强,气态氢化物的热稳定性越强,故C错误;
D.原子核外电子层数越多,半径越大,同周期元素从左到右原子半径逐渐减小,则原子半径最大的为S,故D错误.
故选A.
点评 此题主要考查了元素周期律以及原子核外电子排布知识,为高频考点,侧重于学生的分析能力的考查,题目难度不大,注意把握原子的结构特点.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
13.下列物质中,既有离子键,又有共价键的是( )
| A. | H2O | B. | CaCl2 | C. | KOH | D. | Na2O2 |
14.如图是化学实验常用装置之一,若气体从右管进入,可用来收集的气体是( )
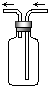

| A. | NO | B. | CO | C. | NH3 | D. | SO2 |
11.下列元素中属于主族元素的是( )
| A. | 铁 | B. | 硫 | C. | 氮 | D. | 碘 |
18.为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失.下列物质中有可能作为稳定剂的是( )
| A. | Na2S2O3 | B. | AlCl3 | C. | Na2CO3 | D. | NaNO2 |
8.下列能用分液漏斗分离的混合物是( )
| A. | 液溴和四氯化碳 | B. | 乙酸和乙醇 | ||
| C. | 乙酸乙酯和蒸馏水 | D. | 溴苯和苯 |
15.下列有关物质结构和性质的叙述正确的是( )
| A. | 若两种粒子的核外电子排布完全相同,则其化学性质一定相同 | |
| B. | 凡单原子形成的离子,一定具有稀有气体元素原子核外电子排布 | |
| C. | 金属元素的原子肯定不可能出现在阴离子中 | |
| D. | 两中性原子的核外电子排布相同,则一定属于同种元素 |
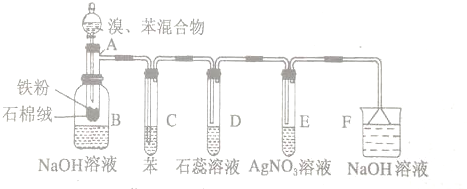
 Ω=2,则有机物
Ω=2,则有机物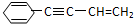 的不饱和度为( )
的不饱和度为( )