题目内容
13.下列物质中,既有离子键,又有共价键的是( )| A. | H2O | B. | CaCl2 | C. | KOH | D. | Na2O2 |
分析 一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,碱金属族元素、碱土金属元素和第VIA族、第VIIA族元素之间易形成离子键,据此分析解答.
解答 解:A.水分子中H-O原子之间只存在共价键,故A错误;
B.氯化钙中钙离子和氯离子之间只存在离子键,故B错误;
C.KOH中钾离子和氢氧根离子之间存在离子键、O-H原子之间存在共价键,故C正确;
D.过氧化钠中钠离子和过氧根离子之间存在离子键、O-O原子之间存在共价键,故D正确;
故选CD.
点评 本题考查离子键和共价键的判断,侧重考查基本概念,根据物质构成微粒确定化学键,注意离子键和共价键的区别,会正确书写过氧化钠电子式,题目难度不大.

练习册系列答案
相关题目
3.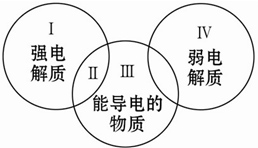 对下列物质:①镁 ②石墨 ③熔融氯化钠 ④盐酸 ⑤稀硫酸 ⑥氨水 ⑦白磷 ⑧硫酸钡 ⑨冰醋酸 ⑩二氧化碳,分类正确的是( )
对下列物质:①镁 ②石墨 ③熔融氯化钠 ④盐酸 ⑤稀硫酸 ⑥氨水 ⑦白磷 ⑧硫酸钡 ⑨冰醋酸 ⑩二氧化碳,分类正确的是( )
 对下列物质:①镁 ②石墨 ③熔融氯化钠 ④盐酸 ⑤稀硫酸 ⑥氨水 ⑦白磷 ⑧硫酸钡 ⑨冰醋酸 ⑩二氧化碳,分类正确的是( )
对下列物质:①镁 ②石墨 ③熔融氯化钠 ④盐酸 ⑤稀硫酸 ⑥氨水 ⑦白磷 ⑧硫酸钡 ⑨冰醋酸 ⑩二氧化碳,分类正确的是( )| A. | Ⅰ包含的物质有③④⑤⑧ | B. | Ⅱ中包含的物质是③ | ||
| C. | Ⅲ中包含的物质是①②③⑤⑥⑧ | D. | Ⅳ中包含的物质是⑥⑨⑩ |
4.对于工业合成氨反应:N2+H2═2NH3,下列说法错误的是( )
| A. | 使用合适的催化剂可以加快反应的速率 | |
| B. | 升高温度可以加快反应速率 | |
| C. | 减小压强能加快反应速率 | |
| D. | 增大N2浓度可以加快反应速率 |
8.下列一卤代烷不能发生消去反应的是( )
| A. | CH3CH2Cl | B. | (CH3)3CCH2Cl | C. | (CH3)3CCl | D. | (CH3)2CHCl |
5.生活中我们常用到铝制餐具.铝在空气中稳定存在的原因是( )
| A. | 铝能产生铝热反应 | B. | 铝的化学性质不活泼 | ||
| C. | 常温下铝不能与氧气反应 | D. | 铝表面能形成致密的氧化膜 |
2.用NA表示阿伏德罗常数,下列叙述正确的是( )
| A. | 物质的量浓度为0.5mol•L-1的MgCl2溶液中,含有Cl-个数为1 NA | |
| B. | 标准状况下,11.2 L S03含有的分子数为0.5NA | |
| C. | 1 mol Na2O2含离子数为4NA | |
| D. | 24 g O2分子和24 g O3分子所含的氧原子数目相等 |
3.现有部分短周期元素的性质或原子结构如下表:
下列有关说法中正确的是( )
| 元素编号 | 元素性质或原子结构 |
| T | M层上的电子数是原子核外电子层数的2倍 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
| A. | 元素的非金属性:Z>T>X | |
| B. | 最高价氧化物对应水化物的酸性:T>Z | |
| C. | 气态氢化物的热稳定性:X>Y | |
| D. | 四种元素中原子半径最大的是Z |

 .
. 如图是一个化学过程的示意图.
如图是一个化学过程的示意图.