题目内容
【题目】(化学——选修3:物质结构与性质)
A、B、C、D为原子序数依次增大的四种元索,A2-和B+具有相同的电子构型;C、 D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是______(填元素符号),其中D原子的核外电子排布式为__________。
(2)单质A有两种同素异形体,其中沸点高的是______(填分子式),原因是________;B和D的氢化物所属的晶体类型分别为_______和_______。
(3)C和D反应可生成组成比为1:3的化合物E, E的立体构型为_______,中心原子的杂化轨道类型为_______,中心原子的价层电子对数为_____________。
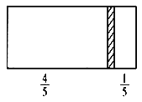
(4)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数,a=0.566nm, 列式计算晶体F的密度(g.cm-3)______________________________。
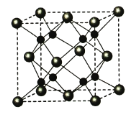
【答案】O1s22s22p63s23p5(或[Ne] 3s23p5)O3O3相对分子质量较大,范德华力大离子晶体分子晶体三角锥形sp34![]()
【解析】
因为A、B、C、D四种元素的原子序数依次增大,A2-和B+具有相同的电子构型,则A是O,B是Na;C、D为同周期元索,C核外电子总数是最外层电子数的3倍,则C是P;D元素最外层有一个未成对电子,所以D是氯元素,据此分析可得结论。
(1)非金属性越强,电负性越大,则四种元素中电负性最大的是O;Cl的原子序数是17,则根据核外电子排布可知D原子的核外电子排布布式为1s22s22p63s23p5(或[Ne] 3s23p5);(2)氧元素有氧气和臭氧两种单质,由于O3相对分子质量较大,范德华力大,所以中沸点高的是O3;B和D的氢化物分别是NaH和HCl,所属的晶体类型分别为分子晶体和离子晶体,故答案为:O3相对分子质量较大,范德华力大、离子晶体、分子晶体;(3)C和D反应可生成组成比为1:3的化合物E,即E是PCl3, 其中P含有一对孤对电子,其价层电子对数是4,所以E的立体构型为三角锥形,中心原子的杂化轨道类型为sp3,故答案为:三角锥形、sp3、4;(4)由晶胞结构和均摊法分析可知其中含有的钠离子个数为8(全部在晶胞内),氧离子个数为8×![]() +6×
+6×![]() =4,晶胞的质量为
=4,晶胞的质量为![]() ,晶胞的体积为(0.566×10-7)3cm3,则晶体F的密度为
,晶胞的体积为(0.566×10-7)3cm3,则晶体F的密度为![]() =2.27gcm-3。
=2.27gcm-3。

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案【题目】下列关于胶体的叙述中不正确的是
A. 丁达尔现象可用来区别胶体与溶液
B. 溶液、胶体、浊液的根本区别是分散质粒子直径的大小
C. 胶体在一定条件下会发生聚沉
D. 胶体粒子能通过半透膜,不能通过滤纸
【题目】在探究新制氯水成分及性质的实验中,依据下列方法和现象,不能得出相应结论的是
方法 | 现象 | 结论 | |
A | 观察氯水颜色 | 氯水呈黄绿色 | 氯水中含Cl2 |
B | 向饱和NaHCO3溶液中加入足量氯水 | 有无色气体产生 | 氯水中含HClO |
C | 向红色纸条上滴加氯水 | 红色纸条褪色 | 氯水具有漂白性 |
D | 向FeCl2溶液中滴加氯水 | 溶液变成棕黄色 | 氯水具有氧化性 |
A. A B. B C. C D. D