题目内容
下列有关电解质溶液中微粒的物质的量浓度关系不正确的是( )
c(H+)+c(M+)=c(OH一)+c(A一)
| A.常温,pH=8的NaA溶液中:c(Na+)— c(A一)=9.9×10-7 mol·L-l |
| B.0.lmol·L-1的(NH4)2SO4溶液中,c(SO42—)>c(NH4+)>c(H+)>c(OH一) |
| C.物质的量浓度相等的①NaClO、②CH3COONa、③NaCl溶液,离子总浓度③>②>① |
| D.25℃时,pH=2的HA溶液与pH=12的MOH溶液以任意比混合后,所得溶液中: |
B
答案:B
B.不正确,0.lmol·L-1的(NH4)2SO4溶液中,NH4+应是SO42―的2倍,但NH4+ 少部分水解,所以,2c(SO42—)>c(NH4+)>c(SO42—)> c(H+)>c(OH一);
A、正确,根据电荷守恒:c(Na+)— c(A一)= c(OH―)— c(H+ )=10-6 mol·L-l―10-8 mol·L-l==9.9×10-7 mol·L-l
C、正确,水解能力强的留下的H+ 浓度小,离子总浓度小;
D、正确,电荷守恒。

练习册系列答案
相关题目

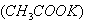 是融雪效果较好的融雪剂,下列关于醋酸钾说法正确的是( )
是融雪效果较好的融雪剂,下列关于醋酸钾说法正确的是( )  质量为98
质量为98 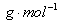
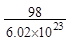 g
g 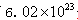 个碳原子的
个碳原子的

 各写一个非氧化还原
各写一个非氧化还原 反应的方程式和氧化还原反应的方程式:________________________________,____________________________________
反应的方程式和氧化还原反应的方程式:________________________________,____________________________________