题目内容
【题目】在一个容积固定的反应器中,有一可左右滑动的密封隔板,左、右两侧分别进行如下可逆反应:2SO2(g)+O2(g) ![]() 2SO3(g);3Fe(s)+4H2O(g)
2SO3(g);3Fe(s)+4H2O(g) ![]() Fe3O4(s)+4H2(g)。左侧中加入SO2、O2、SO3的物质的量分别为xmol、3.25mol、1mol;右侧中加入9mol的水蒸气和适量的铁粉(忽略铁粉对容器体积的影响)当x在一定范围内变化时,均可以通过调节反应器的温度,使两侧反应都达到平衡,并且隔板恰好处于反应器位置2处
Fe3O4(s)+4H2(g)。左侧中加入SO2、O2、SO3的物质的量分别为xmol、3.25mol、1mol;右侧中加入9mol的水蒸气和适量的铁粉(忽略铁粉对容器体积的影响)当x在一定范围内变化时,均可以通过调节反应器的温度,使两侧反应都达到平衡,并且隔板恰好处于反应器位置2处![]() 请填写以下空白:
请填写以下空白:

(1)若x=1.5则左侧反应在起始时向 ______(填“正反应”或“逆反应”)方向进行![]() 欲使反应维持向该方向进行,则x的取值范围是 ______ 。
欲使反应维持向该方向进行,则x的取值范围是 ______ 。
(2)若X=2,则左侧反应在起始时向 ______填“正反应”或“逆反应”)方向进行,平衡时混合气中SO2所占的体积分数为 ______ 。
【答案】逆反应 1.25<x<1.75 正反应 0.25
【解析】
试题(1)这两个平衡体系的特点是:第一个反应前后气体的总物质的量发生变化,第二个保持不变,故右边永远是9mol气体,同在一个容器中,同温同压,故气体的物质的量之比等于体积之比。故平衡时,左边为6mol气体;当x=1.5时,左边现在总的物质的量为5.75mol<6mol,故向逆反应方向进行;若保持该方向,1.25<x<1.75;
(2)根据上述,反应向正反应方向进行了

平衡总物质的量为6mol,即 2-2y+3.25-y +1+2y= 6mol,解之,得y =0.25mol,2-2y =1.5,二氧化硫的体积分数="1.5/6=25%" ;

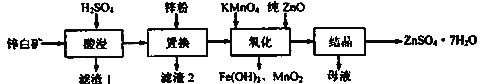
【题目】硫酸锌可用于制造锌钡白、印染媒染剂等。用锌白矿(主要成分为ZnO,还含有Fe2O3、CuO、SiO2等杂成) 制备ZnSO4 ·7H2O的流程如下。
相关金属离了生成氢氧化物沉淀的pH (开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)如下表:
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Zn2+ | 6.4 | 8.0 |
(1)“滤渣1”的主要成分为_________(填化学式)。“酸浸”过程中,提高锌元素浸出率的措施有:适当提高酸的浓度、______________(填一种)。
(2)“置换”过程中,加入适量的锌粉,除与溶液中的Fe3+,H+反应外,另一主要反应的化学方程式为__________________________。
(3)“氧化”一步中,发生氧化还原反应的离子方程式为_______________________。溶液pH控制在[3.2,6.4)之间的目的是_______________________________。
(4)“母液”中含有的盐类物质有_________ (填化学式)。
(5)ZnSO4 ·7H2O可用于配制铁件上镀锌电镀池的电解液,下列说法不正确的是_______
A.配制一定物质的量浓度ZnSO4溶液时必需的玻璃仪器为容量瓶、烧杯、玻璃棒
B.电镀池的阳极为铁件
C.阴极质量增加65g时,理论上导线中通过2mol电子
D.电镀过程中电解质溶液的浓度不变