题目内容
下列实验操作及现象能够达到对应实验目的的是
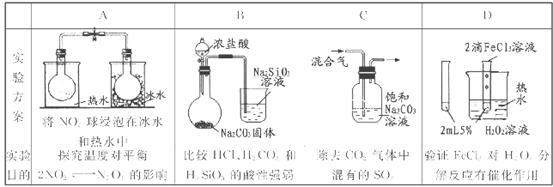
| | 实验内容 | 实验目的 |
| A | 将SO2通入品红溶液中,品红褪色;加热褪色后品红溶液,溶液恢复红色 | 证明亚硫酸的不稳定性 |
| B | 常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有少量气泡产生 | 证明常温下KSP(BaSO4)>KSP(BaCO3) |
| C | 常温下测定物质的量浓度相同的盐酸和醋酸溶液的pH:盐酸pH小于醋酸pH | 证明相同条件下,在水中HCl电离程度大于CH3COOH |
| D | 将浓硫酸和碳混合加热,直接将生成的气体通入足量的澄清石灰水,石灰水变浑浊 | 检验气体产物中CO2的存在 |
C
试题分析:A、将SO2通入品红溶液中,品红褪色;加热褪色后品红溶液,溶液恢复红色,这说明SO2的漂白是不稳定的,而不能说明亚硫酸的不稳定性,A不正确;B、常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有少量气泡产生,这说明反应中有碳酸钡沉淀产生,这与碳酸钡和硫酸钡的溶度积常数并无直接关系。因为只要溶液中c(Ba2+)·c(SO42-)>KSP(BaCO3)即可产生碳酸钡沉淀,B不正确;C、常温下测定物质的量浓度相同的盐酸和醋酸溶液的pH:盐酸pH小于醋酸pH,这说明盐酸溶液中氢离子浓度大于醋酸溶液中氢离子浓度。因此在物质的量浓度相同的条件下,说明盐酸的电离程度要大于醋酸的电离程度,C正确;D、在加热的条件下浓硫酸与碳加热反应生成CO2、SO2和水。由于SO2也能和澄清石灰水反应产生白色沉淀,所以根据石灰水变浑浊不能说明有CO2生成,D不正确,答案选C。

练习册系列答案
相关题目