题目内容
室温下,某溶液中由水电离产生的c(H+)、c(OH-)满足c(H+)·c(OH-)=10-24,则下列各组离子在该溶液中可能大量共存的是
| A.NH4+、Fe2+、NO3-、SO42- |
| B.Ba2+ 、Na+、Cl-、NO3- |
| C.Na+、Cl-、SO42-、HCO3- |
| D.HCO3-、Na+、AlO2-、Cl- |
B
解析试题分析:解:由水电离产生的c(H+)和 c(OH-)满足c(H+)?c(OH-)=10-24,c水(H+)=10-12,为酸或碱溶液。A、酸溶液中不能大量存在AlO2-,故A错误;B、无论酸或碱溶液中该组离子之间不反应,能大量共存,故B正确;C、酸溶液中Fe2+、H+、NO3-发生氧化还原反应,碱溶液中不能大量存在Fe2+,不能大量共存,故C错误;D、碱溶液中不能大量存在NH4+,故D错误。
考点:溶液电离平衡

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案下列事实、离子方程式及其对应关系均正确的是
| A.铁溶于稀硝酸,溶液变为浅绿色:Fe + 4H+ + NO3—= Fe3+ + NO ↑ + 2H2O |
B.向K2Cr2O7溶液中滴加少量浓H2SO4,溶液变为黄色:Cr2O72-(橙色) + H2O  2CrO42-(黄色) +2H+ 2CrO42-(黄色) +2H+ |
| C.向淀粉碘化钾溶液中滴加稀硫酸,在空气中放置一段时间后溶液变蓝:4H+ + 4I- + O2 =2I2 + 2H2O |
D.向水杨酸(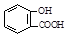 )中滴加NaHCO3溶液,放出无色气体: )中滴加NaHCO3溶液,放出无色气体: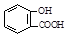 + 2HCO3- → + 2HCO3- →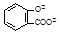 + 2CO2↑ + 2H2O + 2CO2↑ + 2H2O |
已知SO32-的还原性大于I-,某无色溶液中可能含有I-、NH4+、Cu2+、SO32-,向该溶液中加入少量溴水,溶液仍无色,则下列关于溶液组成的判断正确的是
① 肯定不含I- ② 肯定不含Cu2+ ③ 肯定含有SO32- ④ 可能含有I-
| A.①③ | B.①②③ | C.③④ | D.②③④ |
常温下,下列各组离子能大量共存的是
| A.pH=12的溶液中:K+、Na+、Br-、AlO2- |
| B.无色溶液中:H+、K+、MnO4-、C2O42- |
| C.c(Fe3+)="0.1" mol·L-1的溶液中:K+、H+、SCN-、I- |
| D.由水电离出的c(OH-) =1.0×10-13 mol·L-1的溶液中:Na+、NH4+、SO42-、HCO3- |
下列离子方程式错误的是( )
| A.小苏打溶液中加入过量的烧碱溶液:HCO3-+OH-=CO32-+H2O |
| B.澄清石灰水中通入过量的CO2:CO2+OH―=HCO3― |
| C.Cl2与水反应生成盐酸和次氯酸Cl2+H2O=H++Cl―+HClO |
| D.向氯化铝溶液中加入足量氨水:Al3++4NH3·H2O=AlO2―+2H2O +4NH4+ |
下列化学方程式中,能用离子方程式:Ba2++SO42-=BaSO4↓表示的是
| A.Ba(OH)2+(NH4)2SO4=BaSO4↓+2NH3?H2O |
| B.Ba(OH)2+H2SO4=BaSO4↓+2H2O |
| C.BaCO3+H2SO4=BaSO4↓+2H2O+CO2↑ |
| D.BaCl2+ Na2SO4=BaSO4↓+2NaCl |
某强碱性溶液中含有的离子是:K+、NH4+、A13+、AlO2-、CO32-、SiO32-、Cl-中的某几种,现进行如下实验:
①取少量的溶液用足量硝酸酸化后,该溶液无沉淀生成;
②另取一定量原溶液,逐滴加人盐酸至过量,发生的现象是:开始产生沉淀并逐渐增多,沉淀量基本不变后产生一种气体,最后沉淀逐渐减少至消失。
③另取一定量的原溶液中加人5 mL0. 2 mol/L盐酸时,沉淀会完全消失,加人足量的硝酸银溶液可得到沉淀0.187 g。下列说法中正确的是 ( )
| A.该溶液中一定不含NH4+、A13+、SiO32-、Cl- |
| B.该溶液中一定含有A13+、CO32-、Cl- |
| C.Cl-可能含有 |
| D.该溶液中一定含有AlO2-、CO32-、Cl- |
下列表述正确的是
A.含有大量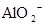 的溶液中:K+、 的溶液中:K+、 、 、 、 、 可共存 可共存 |
B.CO(g)的燃烧热是283.0kJ·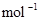 ,则 ,则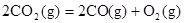 反应的 反应的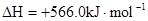 |
C.将SO2通入 溶液中: 溶液中: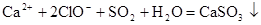 +2HClO +2HClO |
D.在某钠盐溶液中含有等物质的量的 、 、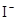 、 、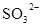 、 、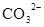 、 、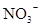 、 、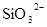 中的一种或多种,当加入过量的盐酸产生气泡,溶液颜色变深但仍澄清,阴离子种数减少3种,则原溶液中一定有 中的一种或多种,当加入过量的盐酸产生气泡,溶液颜色变深但仍澄清,阴离子种数减少3种,则原溶液中一定有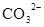 |
下列反应的离子方程式中,书写正确的是
A.氯气溶于水: |
B.将铝粉投入氢氧化钠溶液中: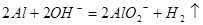 |
C.铜与氯化铁溶液反应: |
D.过氧化钠与水反应: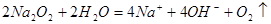 |