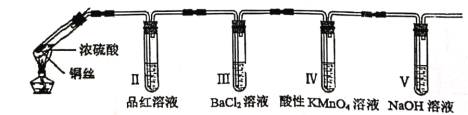
题目内容
【题目】(1)相同温度下等物浓度的下列溶液中,A.NH4C1 B.NH4HCO3 C.NH4HSO4 D.(NH4)2SO4
① pH值由大到小的顺序是___________________(用对应的字母填写)。
② NH4+离子浓度由大到小的顺序是___________________(用对应的字母填写)。
(2)25℃向50 mL 0.018 mol·L-1 的 AgNO3溶液中加入50 mL 0.020 mol·L-l的盐酸,生成沉淀。己知该温度下AgCl的Ksp =l.0×l0-10,忽略溶液的体积变化,请计算:
① 完全沉淀后,溶液中c(Ag+)=_____________。
② 完全沉淀后,溶液的pH=____________。
(3)弱酸及其盐在水中存在多种平衡关系。己知NaA水溶液呈碱性,常温下将0.l mol NaA和0.05 mol HCl溶于水,得到1 L溶液。
① 己知该混合溶液为弱酸性,则溶液中离子浓度由大到小的顺序为___________________。
② 向该混合物中再加0.03mol NaOH,溶液中n(A-) +n(OH-)-n(H+) =________。
(4)三氯化铁是一种重要的化合物,可以用来腐蚀电路板。某腐蚀废液中含有0.5 mol·L-1 Fe3+和0.26 mol·L-1 Cu2+,欲使Fe3+完全沉淀[c(Fe3+) ≤ 4×l0-5 mol·L-1 ]而Cu2+不沉淀,则需控制溶液pH的范围为_________。[KspCu(OH)2 = 2.6×l0-19;KspFe(OH)3 = 4×l0-38]
【答案】 B、A、D、C D、C、A、B 1.0×10-7 mol/L 2 c(Na+) > c(A-) > c(Cl-) > c(H+) > c(OH-) 0.08mol 3 ≤pH≤5
【解析】(1)A.铵根离子水解,溶液呈酸性;B.碳酸氢根离子促进铵根离子水解,酸性较氯化铵溶液酸性弱;C.电离出氢离子,并抑制铵根离子水解,显强酸性;D.铵根离子水解,水解程度不大,铵根离子浓度最大,酸性比氯化铵溶液的酸性强,但是比硫酸氢铵的酸性弱。
①pH值由大到小的顺序是: B、A、D、C ,正确答案: B、A、D、C 。
②NH4+离子浓度由大到小的顺序是D、C、A、B ;正确答案D、C、A、B。
(2)①向50 mL 0.018 mol·L-1 的 AgNO3溶液中加入50 mL 0.020 mol·L-l的盐酸, 混合后两者浓度分别为c(Ag+)=0.018/2=0.009 mol·L-l、c(Cl-)=0.02/2=0.01mol·L-l,由于Ag+与Cl-为等物质的量反应,因此Cl-过量,浓度为c(Cl-)=0.01-0.009=0.001 mol·L-l,根据Ksp =l.0×l0-10,则c(Ag+)= l.0×l0-10/0.001=1.0×10-7 mol/L;正确答案:1.0×10-7 mol/L。
②沉淀生成后,氢离子浓度c=0.02/2=0.01 mol/L,所以溶液的pH=2;正确答案:2。
(3)①常温下将0.l mol NaA和0.05 mol HCl溶于水,得到1 L溶液,所得溶液中含有:0.05 molNaA、0.05molHA、0.05molNaCl;己知该混合溶液为弱酸性,同浓度溶液中HA电离大于![]() 离子的水解, c(A-) > c(Cl-)、c(H+) > c(OH-),则溶液中离子浓度大小为:c(Na+) > c(A-) > c(Cl-) > c(H+) > c(OH-);正确答案:c(Na+) > c(A-) > c(Cl-) > c(H+) > c(OH-)。
离子的水解, c(A-) > c(Cl-)、c(H+) > c(OH-),则溶液中离子浓度大小为:c(Na+) > c(A-) > c(Cl-) > c(H+) > c(OH-);正确答案:c(Na+) > c(A-) > c(Cl-) > c(H+) > c(OH-)。
②向该混合物中再加0.03mol NaOH,酸碱发生中和后,混合液中含有0.05molNaCl、0.08molNaA、0.02 molHA,根据混合液中电荷守恒可得:n(A-) +n(OH-)+ c(Cl-)= c(Na+)+ n(H+),则n(A-) +n(OH-)-n(H+) =c(Na+)-c(Cl-)=0.05+0.08-0.05=0.08 mol;正确答案:0.08 mol。
(4)根据![]() ,当
,当![]() 完全沉淀
完全沉淀![]() 时
时![]() ,此时溶液
,此时溶液![]() ,当
,当![]() 开始沉淀时,根据
开始沉淀时,根据![]() ,
,![]() ,此时溶液
,此时溶液![]() ,则需控制溶液
,则需控制溶液![]() 的范围为3 ≤pH≤5;正确答案:3 ≤pH≤5。
的范围为3 ≤pH≤5;正确答案:3 ≤pH≤5。

【题目】钴酸锂电池应用广泛,电池正极材料主要含有LiCoO2、导电剂乙炔黑、铝箔及少量Fe,可通过下列实验方法回收钴、锂。
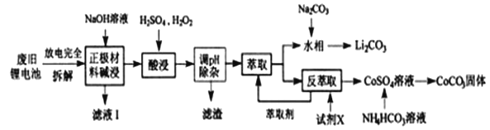
几种金属离子沉淀完全(离子浓度为10-5mo/L)的pH如下表:
离子 | Fe3+ | Al3+ | Fe2+ | Co2+ |
溶液pH | 3.2 | 4.7 | 9.0 | 9.2 |
回答下列问题:
(1)滤液I的主要成分是_________。
(2)已知:氧化性Co3+>H2O2>Fe3+,“酸浸”过程中H2O2所起主要作用是________不能用盐酸代替硫酸,原因是:__________。“调节pH”除去的离子主要有Al3+和_____。
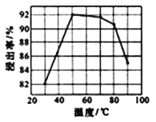
(3)酸浸时浸出率随温度变化如图所示,温度升高至50℃以上时浸出率下降的原因是_________。
(4)“萃取”和“反萃取“可简单表示为:Co2++2(HA)2![]() Co(HA2)2+2H+,则反萃取过程加入的试剂X是____________。
Co(HA2)2+2H+,则反萃取过程加入的试剂X是____________。
(5)向CoSO4溶液中加入NH4HCO3溶液,发生反应的离子方程式为_________。