题目内容
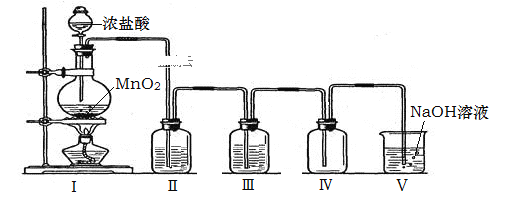
【题目】(1)实验室常用浓盐酸与高锰酸钾发生反应快速制备少量氯气,该反应的化学方程式为:![]() 用双线桥法表示该反应过程中的电子转移情况______________________,该反应中氧化剂为____________,HCl的作用是______________________。
用双线桥法表示该反应过程中的电子转移情况______________________,该反应中氧化剂为____________,HCl的作用是______________________。
(2)KMnO4能与热的经硫酸酸化的Na2C2O4反应,生成Mn2+和CO2,该反应的离子方程式是_________________________________。
(3)已知在碱性溶液中可发生如下反应![]() ,则
,则![]() 中R的化合价是________。
中R的化合价是________。
A.+3 B.+4 C.+5 D.+6
(4)填写下列空白:
①等物质的量的CO和CO2中:所含的分子数目之比为_______,相同条件下体积之比为_______,所含的原子总数目之比为_______。
②有下列物质:
a.硫酸 b.盐酸 c.氯气 d.硫酸钡 e.甲烷 f.铜 g.CH3COOH h.氯化氢 i.蔗糖 j.氨气 k.CO2 l.NaHCO3 m.Al(OH)3 n.NaOH溶液
其中属于非电解质的为_____________(填序号,下同。),属于电解质的为____________。
【答案】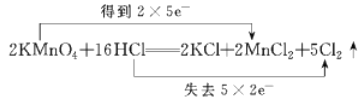 KMnO4 酸和还原剂
KMnO4 酸和还原剂 ![]() D 1:1 1:1 2:3 eijk adghlm
D 1:1 1:1 2:3 eijk adghlm
【解析】
根据化合价变化判断氧化剂、还原剂,用双线桥法分析氧化还原反应;根据题干信息及氧化还原反应原理书写离子方程式;根据电解质及非电解质的概念分析解答。
(1)用双线桥法表示该反应中电子转移情况为: ;Mn元素化合价降低,得电子,作氧化剂,所以氧化剂为KMnO4;HCl中Cl元素化合价有一部分升高为0,有一部分仍为-1,则HCl的作用是 酸和还原剂,故答案为:
;Mn元素化合价降低,得电子,作氧化剂,所以氧化剂为KMnO4;HCl中Cl元素化合价有一部分升高为0,有一部分仍为-1,则HCl的作用是 酸和还原剂,故答案为: ; KMnO4; 酸和还原剂;
; KMnO4; 酸和还原剂;
(2)由KMnO4能与热的经硫酸化的Na2C2O4反应生成Mn2+和CO2,则反应为2KMnO4+5Na2C2O4+8H2SO4![]() K2SO4+2MnSO4+5Na2SO4+10CO2↑+8H2O,离子方式为:
K2SO4+2MnSO4+5Na2SO4+10CO2↑+8H2O,离子方式为:![]() ;
;
(3)根据离子方程式中的电荷守恒得3×1+4×1=3×1+2n,则n=2,所以RO4n为RO42,该离子中O元素化合价为-2价,R、O元素化合价的代数和为-2,所以该离子中R元素化合价=-2-(-2)×4=+6,故答案为:D;
(4)①等物质的量的CO和CO2中,N=NAn,所含的分子数目之比为1:1;相同条件下物质的量之比等于体积之比,所以体积之比为1:1;每个CO分子中含有2个原子,每个CO2分子中含有3个原子,所以原子总数目之比为2:3;
②a.硫酸的水溶液能够导电,硫酸是电解质;
b.盐酸是HCl水溶液,属于混合物,既不是电解质,也不是非电解质;
c.氯气属于单质,既不是电解质,也不是非电解质;
d.硫酸钡是盐,在水溶液中溶解部分完全电离,是强电解质;
e.甲烷是在水溶液中或熔融状态下都不能导电的化合物,属于非电解质;
f.铜是单质,既不是电解质,也不是非电解质;
g.CH3COOH是弱酸,在水溶液里部分电离,属于弱电解质;
h.氯化氢是强酸,在水溶液中完全电离,属于强电解质;
i.蔗糖是在水溶液中或熔融状态下都不能导电的化合物,属于非电解质;
j.氨气是本身无法电离的化合物,属于非电解质;k.CO2本身也无法电离,属于非电解质;l.NaHCO3是盐,在水溶液中完全电离成钠离子和碳酸氢根,属于强电解质;
m.Al(OH)3在水溶液中部分电离,属于弱电解质;
n.NaOH溶液属于混合物,既不是电解质,也不是非电解质,
故属于非电解质的是:eijk,属于电解质的是:adghlm,故答案为:1:1;1:1;2:3;eijk;adghlm。

 名校课堂系列答案
名校课堂系列答案