题目内容
19.为除去括号内的少量杂质,所选用的试剂或方法不正确的是( )| A. | Na2CO3溶液(NaHCO3),加入适量的NaOH溶液 | |
| B. | NaHCO3溶液(Na2CO3),通入过量的CO2气体 | |
| C. | CO2气体(HCl气体),通过饱和的Na2CO3溶液 | |
| D. | SiO2(H2SiO3),加热 |
分析 A.NaOH可与NaHCO3反应生成Na2CO3;
B.Na2CO3溶液与CO2反应生成NaHCO3;
C.二者都与饱和的Na2CO3溶液反应;
D.H2SiO3分解可生成SiO2.
解答 解:A.NaOH可与NaHCO3反应生成Na2CO3,加入适量NaOH,可除去杂质,故A正确;
B.Na2CO3溶液与CO2反应生成NaHCO3,可用于除杂,故B正确;
C.二者都与饱和的Na2CO3溶液反应,应用饱和碳酸氢钠溶液除杂,故C错误;
D.H2SiO3分解可生成SiO2,可用加热的方法除杂,故D正确.
故选C.
点评 本题考查物质的分离和提纯,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质的异同,除杂时不能引入新的杂质.

练习册系列答案
相关题目
10.下列物质间的反应,硫表现出还原性的是( )
| A. | 硫与氢气 | B. | 硫和氧气 | C. | 硫和铁 | D. | 硫和钠 |
7.重金属是指相对原子质量大于55的金属,重金属离子具有毒性.实验室有甲、乙两种含重金属离子的废液,甲废液经化验呈碱性,主要有毒离子为Ba2+.如将甲、乙废液按一定比例混合,毒性明显降低.则乙废液中可能会有的离子是( )
| A. | Cu2+和SO42- | B. | K+和SO42- | C. | Cu2+和Cl- | D. | Ag+和NO3- |
14.下列物质不属于电解质的是( )
| A. | 金刚石 | B. | NaCl | C. | NaOH | D. | BaSO4 |
4.实验室需用480mL0.10mol/L的硫酸铜溶液,以下操作正确的是( )
| A. | 将12.00g胆矾配成500mL溶液 | |
| B. | 将12.50g胆矾溶于少量水中,再用水稀释至500mL | |
| C. | 称取7.68g硫酸铜,加入500mL水 | |
| D. | 在80mL0.6mol/L CuSO4溶液中加入400mL水 |
11.能够证明苯分子不存在碳碳单、双键交替排布的事实是( )
| A. | 苯的一溴代物没有同分异构体 | B. | 苯的间位二溴代物只有一种 | ||
| C. | 苯能在空气中燃烧 | D. | 苯的邻位二溴代物只有一种 |
8.向一体积不变的密闭容器中加入2mol A、0.6mol C和一定量的B三种气体.一定条件下发生反应,各物质浓度随时间变化如图1所示.图2为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件.
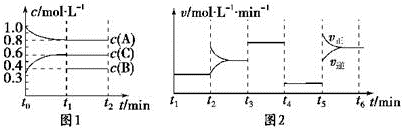
已知t3-t4阶段为使用催化剂;图1中t0-t1阶段c (B)未画出.
(1)若t1=15min,则t0-t1阶段以C浓度变化表示的反应速率为v(C)=0.02mol•L-1•min-1.
(2)(2)t4-t5阶段改变的条件为减小压强,B的起始物质的量为1.0mol.各阶段平衡时对应的平衡常如表所示:
则K1=0.84(保留两位小数),K1、K2、K3、K4、K5之间的关系为K1=K2=K3=K4<K5(用“>”“<”或“=”连接).
(3)t5-t6阶段保持容器内温度不变,若A的物质的量共变化了0.01mol,而此过程中容器与外界的热交换总量为a kJ,写出此温度下该反应的热化学方程式:2A(g)+B(g)?3C(g);△H=+200a kJ•mol-1.
(4)在相同条件下,若起始时容器中加入a mol A、b mol B和c mol C,达到平衡时体系中各物质的量与t1时刻相等,a、b、c要满足的条件为a+$\frac{2}{3}$c=2.4且b+$\frac{1}{3}$c=1.2.

已知t3-t4阶段为使用催化剂;图1中t0-t1阶段c (B)未画出.
(1)若t1=15min,则t0-t1阶段以C浓度变化表示的反应速率为v(C)=0.02mol•L-1•min-1.
(2)(2)t4-t5阶段改变的条件为减小压强,B的起始物质的量为1.0mol.各阶段平衡时对应的平衡常如表所示:
| t1~t2 | t2~t3 | t3~t4 | t4~t5 | t5~t6 |
| K1 | K2 | K3 | K4 | K5 |
(3)t5-t6阶段保持容器内温度不变,若A的物质的量共变化了0.01mol,而此过程中容器与外界的热交换总量为a kJ,写出此温度下该反应的热化学方程式:2A(g)+B(g)?3C(g);△H=+200a kJ•mol-1.
(4)在相同条件下,若起始时容器中加入a mol A、b mol B和c mol C,达到平衡时体系中各物质的量与t1时刻相等,a、b、c要满足的条件为a+$\frac{2}{3}$c=2.4且b+$\frac{1}{3}$c=1.2.
9.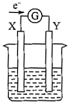 如图所示的原电池装置,X、Y为两电极,电解质溶液为稀硫酸,外电路中的电子流向如图所示,对此装置的下列说法正确的是( )
如图所示的原电池装置,X、Y为两电极,电解质溶液为稀硫酸,外电路中的电子流向如图所示,对此装置的下列说法正确的是( )
 如图所示的原电池装置,X、Y为两电极,电解质溶液为稀硫酸,外电路中的电子流向如图所示,对此装置的下列说法正确的是( )
如图所示的原电池装置,X、Y为两电极,电解质溶液为稀硫酸,外电路中的电子流向如图所示,对此装置的下列说法正确的是( )| A. | 外电路的电流方向为:X→外电路→Y | |
| B. | 若两电极分别为Zn和石墨棒,则X为石墨棒,Y为Zn | |
| C. | 若两电极都是金属,则它们的活动性为X>Y | |
| D. | X极上发生的是还原反应,Y极上发生的氧化反应 |
