题目内容
抗击“非典”期间,过氧乙酸是广为使用的消毒剂,它可由H2O2和、冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2。测定产品中过氧乙酸浓度c0涉及下列反应:
① MnO4- +
MnO4- + H2O2 +
H2O2 + H+ ═
H+ ═ Mn2+ +
Mn2+ + O2 +
O2 +  H2O
H2O
② H2O2 + 2I- + 2 H+ ═ I2 + 2 H2O
③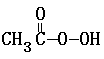 + 2I- + 2 H+ ═ CH3COOH + I2 + 2 H2O
+ 2I- + 2 H+ ═ CH3COOH + I2 + 2 H2O
④I2 + 2S2O32- ═ S4O62- + 2 I-
请回答下列问题:
(1)配平反应①的离子方程式:
 MnO4- +
MnO4- + H2O2 +
H2O2 + H+ ═
H+ ═  Mn2++
Mn2++  O2 +
O2 +  H2O
H2O
(2)用Na2S2O3标准溶液滴定I2是(反应④)选用的指示剂是 。
(3)取b0mL待测液,用硫酸使溶液酸化,再用浓度为a1mol·L-1的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1mL(反应①,滴定过程中KMnO4不与过氧乙酸反应)。
另取b0mL待测液,加入过量的KI,并用硫酸使溶液酸化,此时过氧乙酸和残留的H2O2都能跟KI反应生成I2(适应②和③)。再用浓度为a2mol·L-1的Na2S2O3标准溶液滴定生成的I2,,耗用Na2S2O3的体积为b2mL。
请根据上述实验数据计算过氧乙酸的浓度(用含a1、a2、 b1 、b2、b0的代数表示)
c0 = .
(4)为计算待测液中过氧乙酸的浓度c0,加入的KI的质量已过量但没有
准确称量,是否影响测定结果 (填是或否)。
①
 MnO4- +
MnO4- + H2O2 +
H2O2 + H+ ═
H+ ═ Mn2+ +
Mn2+ + O2 +
O2 +  H2O
H2O② H2O2 + 2I- + 2 H+ ═ I2 + 2 H2O
③
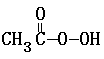 + 2I- + 2 H+ ═ CH3COOH + I2 + 2 H2O
+ 2I- + 2 H+ ═ CH3COOH + I2 + 2 H2O④I2 + 2S2O32- ═ S4O62- + 2 I-
请回答下列问题:
(1)配平反应①的离子方程式:
 MnO4- +
MnO4- + H2O2 +
H2O2 + H+ ═
H+ ═  Mn2++
Mn2++  O2 +
O2 +  H2O
H2O(2)用Na2S2O3标准溶液滴定I2是(反应④)选用的指示剂是 。
(3)取b0mL待测液,用硫酸使溶液酸化,再用浓度为a1mol·L-1的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1mL(反应①,滴定过程中KMnO4不与过氧乙酸反应)。
另取b0mL待测液,加入过量的KI,并用硫酸使溶液酸化,此时过氧乙酸和残留的H2O2都能跟KI反应生成I2(适应②和③)。再用浓度为a2mol·L-1的Na2S2O3标准溶液滴定生成的I2,,耗用Na2S2O3的体积为b2mL。
请根据上述实验数据计算过氧乙酸的浓度(用含a1、a2、 b1 、b2、b0的代数表示)
c0 = .
(4)为计算待测液中过氧乙酸的浓度c0,加入的KI的质量已过量但没有
准确称量,是否影响测定结果 (填是或否)。
(1) 2 5 6 2 5 8 (3分) (2) 淀粉溶液 (2分)
(3)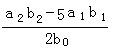 (3分) (4)否 (2分)
(3分) (4)否 (2分)
(3)
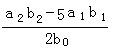 (3分) (4)否 (2分)
(3分) (4)否 (2分)(1)反应中Mn的化合价从+7价降低到+2价,得到2个电子。双氧水中氧元素的化合价从-1价升高到0价,失去1个电子,所以根据电子得失守恒可知,氧化剂和还原剂的物质的量之比是2︰5,则方程式中系数分别是2 5 6 2 5 8。
(2)由于碘单质能和淀粉发生显色反应,所以指示剂是淀粉。
(3)根据反应①可知溶液中含有双氧水是0.0025a1b1mol,则根据反应②可知双氧水氧化生成的碘单质是0.0025a1b1mol。根据反应④可知生成的碘单质根据是0.0005a2b2mol,所以由过氧乙酸生成的碘单质是0.0005a2b2mol-0.0025a1b1mol,因此根据反应③可知过氧乙酸的物质的量是0.0005a2b2mol-0.0025a1b1mol,所以其浓度是
(4)根据(3)可知,反应是过量的碘化钾不参与反应,所以不影响结果。
(2)由于碘单质能和淀粉发生显色反应,所以指示剂是淀粉。
(3)根据反应①可知溶液中含有双氧水是0.0025a1b1mol,则根据反应②可知双氧水氧化生成的碘单质是0.0025a1b1mol。根据反应④可知生成的碘单质根据是0.0005a2b2mol,所以由过氧乙酸生成的碘单质是0.0005a2b2mol-0.0025a1b1mol,因此根据反应③可知过氧乙酸的物质的量是0.0005a2b2mol-0.0025a1b1mol,所以其浓度是

(4)根据(3)可知,反应是过量的碘化钾不参与反应,所以不影响结果。

练习册系列答案
相关题目
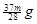
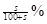
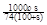 mol/L
mol/L