题目内容
(8分)有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3物质的量浓度分别是4mol/L和2mol/L,取10mL此混合酸,向其中加入过量的铁粉,待反应结束后,可产生标准状况下的气体多少升?(设反应中HNO3被还原成NO)
n(H+)="0.10mol," n(NO3-)=0.02mol
3Fe + 8H+ + 2NO3— = 3Fe2+ + 2NO + 4H2O
8mol 2mol
0.10mol 0.02mol
∴n(H+,过量)=0.10mol-0.08mol="0.02mol" …………1分
生成的NO为:n(NO)=0.02mol …………1分(2)过量的H+继续与Fe反应
Fe + 2H+ = Fe2+ + H2
2mol 1mol
0.02mol 0.01mol
又生成氢气为:n(H2)="0.01mol" …………1分
n(气)="0.02mol+0.01mol=0.03mol" …………1分
V(气)=n(气)×Vm="0.03mol×22.4L/mol=0.672L" …………(2分)
3Fe + 8H+ + 2NO3— = 3Fe2+ + 2NO + 4H2O
8mol 2mol
0.10mol 0.02mol
∴n(H+,过量)=0.10mol-0.08mol="0.02mol" …………1分
生成的NO为:n(NO)=0.02mol …………1分(2)过量的H+继续与Fe反应
Fe + 2H+ = Fe2+ + H2
2mol 1mol
0.02mol 0.01mol
又生成氢气为:n(H2)="0.01mol" …………1分
n(气)="0.02mol+0.01mol=0.03mol" …………1分
V(气)=n(气)×Vm="0.03mol×22.4L/mol=0.672L" …………(2分)
考查根据方程式进行的有关计算。

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案
相关题目
 MnO4- +
MnO4- +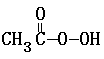 + 2I- + 2 H+ ═ CH3COOH + I2 + 2 H2O
+ 2I- + 2 H+ ═ CH3COOH + I2 + 2 H2O