题目内容
由CO2、H2O(g)组成的混合气体共a mol,其中CO2的物质的量分数为x。将该混合气体缓慢通过装有1mol Na2O2的真空管,充分反应后,维持120℃、1.01×105Pa。收集所得气体,冷却、称量,真空管中固体质量增加y g。
(1)若a=1,则y=____________(用含x代数式表示);
(2)若a=2,x=0.5时,反应后所得气体的成份是_____________;
(3)若a=2,y=28时,则x的取值范围____________________;
(4)若a=1.25,试在图中作出y与x的关系曲线,并在y轴标明曲线起点和终点的数值。
(1)若a=1,则y=____________(用含x代数式表示);
(2)若a=2,x=0.5时,反应后所得气体的成份是_____________;
(3)若a=2,y=28时,则x的取值范围____________________;
(4)若a=1.25,试在图中作出y与x的关系曲线,并在y轴标明曲线起点和终点的数值。
(1)y=26x+2 (2)H2O、O2 (3)0.5≤x<1
(4)

(4)

(1)若a=1,则CO2是xmol,水蒸气是(1-x)mol。根据方程式2Na2O2+2CO2=4NaOH+O2↑、2Na2O2+2CO2=2Na2CO3+O2可知y=28x+2-2x=26x+2。
(2)若a=2,x=0.5时,CO2和水蒸气分别都是1mol。由于过氧化钠是1mol,则只有CO2和过氧化钠恰好反应,而水蒸气是不反应的。所以最终气体是水蒸气和氧气。
(3)若a=2,则过氧化钠是不足的。由于过氧化钠首先和CO2反应,所以当y=28时,根据方程式可知,参加反应的CO2是1mol,因此X的取值范围是0.5≤x<1。
4)若a=1.25,则过氧化钠还是不足的。如果气体只有水蒸气,则y=2;如果只有CO2,则y=28,由于过氧化钠首先和CO2反应,即1mol过氧化钠消耗1molCO2,则此时CO2的物质的量分数是x=0.8,所以图像是(见答案)。
(2)若a=2,x=0.5时,CO2和水蒸气分别都是1mol。由于过氧化钠是1mol,则只有CO2和过氧化钠恰好反应,而水蒸气是不反应的。所以最终气体是水蒸气和氧气。
(3)若a=2,则过氧化钠是不足的。由于过氧化钠首先和CO2反应,所以当y=28时,根据方程式可知,参加反应的CO2是1mol,因此X的取值范围是0.5≤x<1。
4)若a=1.25,则过氧化钠还是不足的。如果气体只有水蒸气,则y=2;如果只有CO2,则y=28,由于过氧化钠首先和CO2反应,即1mol过氧化钠消耗1molCO2,则此时CO2的物质的量分数是x=0.8,所以图像是(见答案)。

练习册系列答案
相关题目


 MnO4- +
MnO4- +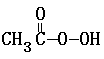 + 2I- + 2 H+ ═ CH3COOH + I2 + 2 H2O
+ 2I- + 2 H+ ═ CH3COOH + I2 + 2 H2O