题目内容
【题目】五氯化磷(PCl5)是有机合成中重要的氯化剂,可以由三氯化磷(PCl3)氯化得到:
PCl3(g)+Cl2(g)![]() PCl5(g) ΔH=-93.0 kJ·mol-1。某温度下,在容积恒定为2.0 L的密闭容器中充入2.0 mol PCl3和1.0 mol Cl2,一段时间后反应达平衡状态,实验数据如下表所示:
PCl5(g) ΔH=-93.0 kJ·mol-1。某温度下,在容积恒定为2.0 L的密闭容器中充入2.0 mol PCl3和1.0 mol Cl2,一段时间后反应达平衡状态,实验数据如下表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl5)/mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
(1)0~150 s内的平均反应速率v(PCl3)=________mol·L-1·s-1。
(2)该温度下,此反应的化学平衡常数的数值为____(可用分数表示)。
(3)反应至250 s时,该反应放出的热量为________kJ。
(4)下列关于上述反应的说法中,正确的是______(填字母)。
a.无论是否达平衡状态,混合气体的密度始终不变
b.300 s时,升高温度,正、逆反应速率同时增大
c.350 s时,向该密闭容器中充入氮气,平衡向正反应方向移动
d.相同条件下,若起始向该密闭容器中充入1.0 mol PCl3和0.2 mol Cl2,达到化学平衡状态时,n(PCl5)<0.20 mol
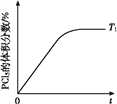
(5)温度T1时,混合气体中PCl5的体积分数随时间t变化的示意图如上。其他条件相同,请在上图中画出温度为T2(T2>T1)时,PCl5的体积分数随时间变化的曲线________。
【答案】 1.2×10-3或0.001 2 0.83或5/6 37.2 abd 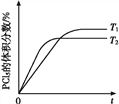
【解析】(1)0~150s内的平均反应速率v(PCl5)= ![]() ==
==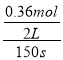 =1.2×10-3mol·L-1s-1,该段时间内v(PCl3)=v(PCl5)=1.2×10-3mol·L-1s-1,故答案为:1.2×10-3;
=1.2×10-3mol·L-1s-1,该段时间内v(PCl3)=v(PCl5)=1.2×10-3mol·L-1s-1,故答案为:1.2×10-3;
(2)开始时c(PCl3)= ![]() =1.0mol/L、c(Cl2)=
=1.0mol/L、c(Cl2)= ![]() =0.5mol/L,平衡时c(PCl5)=
=0.5mol/L,平衡时c(PCl5)= ![]() =0.2mol/L,
=0.2mol/L,
PCl3(g)+Cl2(g) ![]() PCl5(g)
PCl5(g)
开始(mol/L) 1.0 0.5 0
反应(mol/L) 0.2 0.2 0.2
平衡(mol/L) 0.80.3 0.2
化学平衡常数K=![]() =
=![]() =
=![]() ,故答案为:
,故答案为: ![]() ;
;
(3)生成1mol五氯化磷放出93.0kJ热量,250s时生成n(PCl5)=0.40mol放出热量=0.40mol×93.0kJ/mol=37.2kJ,故答案为:37.2;
(4)a.反应前后气体总质量不变、容器体积不变,根据ρ=![]() 知,无论反应是否达到平衡状态密度始终不变,故a正确;b.所有的化学反应只要升高温度正逆反应速率都增大,所以该反应升高温度正逆反应速率都增大,故b正确;c.350s时,向该密闭容器中充入氮气,参加反应的各气体分压不变、浓度不变,则化学平衡不移动,故c错误;d.相同条件下,若起始向该密闭容器中充入1.0molPCl3和0.2molCl2,与原反应相比,相当于减小压强平衡向气体体积增大的方向移动,则生成五氯化磷物质的量小于原来一半,故d正确;故选abd;
知,无论反应是否达到平衡状态密度始终不变,故a正确;b.所有的化学反应只要升高温度正逆反应速率都增大,所以该反应升高温度正逆反应速率都增大,故b正确;c.350s时,向该密闭容器中充入氮气,参加反应的各气体分压不变、浓度不变,则化学平衡不移动,故c错误;d.相同条件下,若起始向该密闭容器中充入1.0molPCl3和0.2molCl2,与原反应相比,相当于减小压强平衡向气体体积增大的方向移动,则生成五氯化磷物质的量小于原来一半,故d正确;故选abd;
(5)该反应的正反应是放热反应,升高温度化学反应速率加快,反应达到平衡时间缩短,但平衡逆向移动,达到平衡时五氯化磷体积分数降低,所以PCl5的体积分数随时间变化的曲线为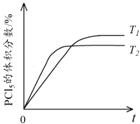 ,故答案为:
,故答案为: 。
。


