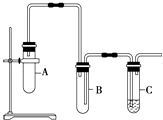
题目内容
【题目】(1)通常状态下,在100mL的针筒里充有80mL的氯气,观察针筒里的现象是______;铁在氯气中剧烈燃烧的产物在水溶液中的电离方程式:______________________________________
(2)洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一,漂白粉是常用的消毒剂
①工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为___________________
②漂白粉的主要成分是(填化学式)____________
(3)请写出一种适合实验室制备氯气的反应方程式:__________________________________,该反应中若有1.00mol还原剂被氧化,则有________g氧化剂被还原。
【答案】 有黄绿色气体 FeCl3=Fe3++3Cl- 2Ca(OH) 2+2Cl2==CaCl2+Ca(ClO) 2 +2H2O CaCl2、Ca(ClO) 2 4HCl(浓)+MnO2![]() MnCl2+2H2O+Cl2↑ 43.5g
MnCl2+2H2O+Cl2↑ 43.5g
【解析】(1)通常状态下,在100mL的针筒里充有80mL的氯气,观察针筒里的现象是有黄绿色气体;铁在氯气中剧烈燃烧的产物是氯化铁,在水溶液中的电离方程式为FeCl3=Fe3++3Cl-;(2)①工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O;②漂白粉的主要成分是CaCl2、Ca(ClO)2;(3)实验室制备氯气的反应方程式可以是4HCl(浓)+MnO2![]() MnCl2+2H2O+Cl2↑,该反应中若有1.00mol还原剂被氧化,转移1mol电子。Mn元素化合价从+4价降低到+2价,得到2个电子,则根据电子得失守恒可知有0.5mol二氧化锰即0.5mol×87g/mol=43.5g氧化剂被还原。
MnCl2+2H2O+Cl2↑,该反应中若有1.00mol还原剂被氧化,转移1mol电子。Mn元素化合价从+4价降低到+2价,得到2个电子,则根据电子得失守恒可知有0.5mol二氧化锰即0.5mol×87g/mol=43.5g氧化剂被还原。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案