题目内容
12.a g CuO、Al2O3、MgO组成的混合物全部溶于20mL某酸溶液中,反应后向所得溶液中加入10mL氢氧化钠溶液,得到的沉淀量最大.则下列对应关系正确的是( )| 选项 | 酸溶液 | c(NaOH) |
| A | pH=1的硫酸 | 0.4mol/L |
| B | pH=1的硝酸 | 0.4mol/L |
| C | 0.1mol/L的硫酸 | 0.2mol/L |
| D | 0.1mol/L的盐酸 | 0.2mol/L |
| A. | A | B. | B | C. | C | D. | D |
分析 反应后向所得溶液中加入10mL氢氧化钠溶液,得到沉淀的量最大时,加入氢氧化钠溶液中的氢氧根离子的物质的量与酸中氢离子的总物质的量一定相等,据此对各选项进行判断.
解答 解:A.pH=1的硫酸中氢离子浓度为0.1mol/L,20mL该硫酸中含有氢离子的物质的量为:0.1mol/L×0.02L=0.002mol,10mL0.4mol/L的氢氧化钠溶液中含有氢氧根离子的物质的量为:0.4mol/L×0.01L=0.004mol,氢氧化钠过量,部分氢氧化铝溶解,生成的沉淀不是增大,故A错误;
B.pH=1的硝酸中氢离子浓度为0.1mol/L,20mL该硝酸中含有氢离子的物质的量为:0.1mol/L×0.02L=0.002mol,10mL0.4mol/L的氢氧化钠溶液中含有氢氧根离子的物质的量为:0.4mol/L×0.01L=0.004mol>0.002mol,氢氧化钠过量,部分氢氧化铝溶解,生成的沉淀不是增大,故B错误;
C.20mL 0.1mol/L的硫酸中含有氢离子的物质的量为:0.1mol/L×0.02L×2=0.004mol,10mL0.2mol/L的氢氧化钠溶液中含有氢氧根离子的物质的量为:0.4mol/L×0.01L=0.002mol<0.004mol,酸过量,氢氧化钠不足,生成的沉淀不是增大,故C错误;
D.20mL 0.1mol/L的盐酸中含有氢离子的物质的量为:0.1mol/L×0.02L=0.002mol,10mL0.2mol/L的氢氧化钠溶液中含有氢氧根离子的物质的量为:0.4mol/L×0.01L=0.002mol,反应后溶质为氯化钠,此时生成的沉淀最大,故D正确;
故选D.
点评 本题考查了混合物反应的计算,题目难度中等,明确碱溶液中氢氧根离子与水溶液中的氢离子物质的量相等时,生成的沉淀量最大为解答关键,注意掌握溶液酸碱性与溶液pH的关系.

 阅读快车系列答案
阅读快车系列答案| A. | 氮气 | B. | 氢气 | C. | 氧气 | D. | 氯气 |
| A. | 水玻璃 | B. | 二氧化硅 | C. | 一氧化碳 | D. | 氧化铝 |
| A. | Na2CO3 | B. | AgNO3 | C. | NaOH | D. | KNO3 |
| A. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 用食醋除去热水瓶胆中的Mg(OH)2水垢:2H++Mg(OH)2═Mg2++2H2O | |
| C. | 将少量SO2气体通往通往NaClO溶液中:SO2+2ClO-+H2O═SO32-+2HClO | |
| D. | 在硫酸氢钾溶液中加入氢氧化钡溶液至pH=7:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O |
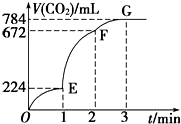 用纯净的CaCO3与100mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况下的体积),下列分析正确的是( )
用纯净的CaCO3与100mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况下的体积),下列分析正确的是( )| A. | OE段表示的平均速率最快 | |
| B. | EF段,用盐酸表示该反应的平均反应速率为0.4 mol•L-1•min-1 | |
| C. | OE、EF、FG三段中,该反应用二氧化碳表示的平均反应速率之比为2:6:7 | |
| D. | F点收集到的CO2的量最多 |
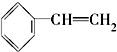 ④
④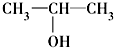 ⑤
⑤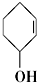 ⑥
⑥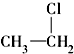 ⑦
⑦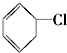 ⑧
⑧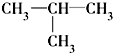 ⑨CH3-CH=CH2 (10)
⑨CH3-CH=CH2 (10)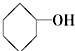 (11)
(11)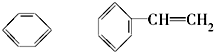 ⑫CH3Cl
⑫CH3Cl
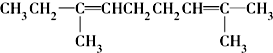 .
.